Kontrolle über das Stammzellprogramm
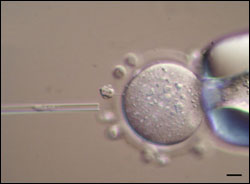
Der Kern einer Körperzelle wird in eine Eizelle injiziert. Forscher bezeichnen das als somatischen Kerntransfer. Bild: Max-Planck-Institut für molekulare Biomedizin
Kontrolliertes Umprogrammieren von Stammzellen durch Kulturbedingungen / Max-Planck-Wissenschaftler mit neuem Konzept für embryonale Stammzellen
Pluripotente Stammzellen lassen sich in alle Zelltypen des Körpers differenzieren. Im gesunden menschlichen Körper konnten sie bislang allerdings nicht nachgewiesen werden. Ihre Herleitung von körpergleichen pluripotenten Zellen über das Verfahren des Kerntransfers in Eizellen wäre sehr wertvoll für die Medizin. Der Kerntransfer in menschliche Eizellen wird allerdings kontrovers diskutiert und ist in vielen europäischen Ländern verboten. Um das Potenzial dieses Verfahrens abschätzen zu können, muss in erster Linie folgende Frage beantwortet werden: Ist das Ergebnis des Zellkerntransfers in Eizellen zufällig oder lässt es sich experimentell kontrollieren? Mit ihren aktuellen Untersuchungen an Mausklonen liefern Wissenschaftler vom Max-Planck-Institut für molekulare Biomedizin in Münster erste Hinweise, dass das Entwicklungspotenzial von Klonen stark von den Kulturbedingungen abhängt und der Prozess des Umprogrammierens zu pluripotenten Stammzellen außerordentlich variabel ist.
Auf regenerativen Therapien durch Zellersatz ruhen viele Hoffnungen von Patienten. Ziel ist es, beschädigte Organe und Gewebe durch Stammzellen in ihrer Funktion wiederherzustellen oder zumindest zu verbessern. Dabei wäre es von Vorteil, Zellen und Gewebe verwenden zu können, die mit dem Patienten genetisch identisch und damit immunologisch gut verträglich sind. Pluripotente Stammzellen sind zwar zelluläre Alleskönner, konnten aber bislang nur in den allerersten embryonalen Stadien nachgewiesen werden und stehen daher nicht für autogene Therapien zur Verfügung. Eine Möglichkeit, solche Zellen zu gewinnen, liegt im somatischen Kerntransfer. Dabei wird der Kern einer vom Patienten stammenden normalen Körperzelle in eine zuvor entkernte Eizelle gebracht. Diese beginnt sich nach einem Stimulus zu teilen und wächst zu einer Blastozyste, die man in eine Kulturschale überführt. Die auswachsenden embryonalen Stammzellen werden anschließend dazu gebracht, sich in bestimmte Zelltypen, beispielsweise Nerven- oder Muskelzellen, zu entwickeln.
Durch die Übertragung des Zellkerns in die Eizelle „verjüngt“ sich der Zustand des Kerns von einer ausdifferenzierten Körperzelle hin zu einer pluripotenten Stammzelle. Die Forscher bezeichnen diesen Prozess als Reprogrammierung. Bei einer Körperzelle wird nur ein bestimmter Satz von Genen abgelesen; viele andere Gene sind abgeschaltet. Um die Zelle wieder in einen frühen Zustand zurückzuversetzen, muss das Ablesen der Gene, die Genexpression, quasi wieder auf die Anfangseinstellung zurückgesetzt werden. Bisher waren Forscher der Ansicht, dass dies innerhalb der ersten Stunden nach Injektion des Zellkerns in die Eizelle geschieht. Das Zurücksetzen sollte rein zufällig erfolgen; seine Natur ist unbekannt und die beteiligten Faktoren liegen – wie Untersuchungen aus der Arbeitsgruppe von Hans Schöler am Max-Planck-Institut für molekulare Biomedizin in Münster nahe legen [1] – nicht im Cytoplasma der Eizelle, sondern in deren Kern.
Michele Boiani und seine Kollegen vom Max-Planck-Institut sind der Frage nachgegangen, wie der Prozess der Reprogrammierung nach dem Kerntransfer abläuft, ob er vollständig ist oder, falls dies nicht der Fall ist, ob es möglich ist, ihn experimentell zu verbessern und zu kontrollieren. Eine solches Verständnis wäre nicht nur aus Sicht der Grundlagenforschung hochinteressant, sondern auch für eine klinische Anwendung von Vorteil. Angesichts der jüngsten Erfolge koreanischer Stammzellforscher ist man beim somatischen Kerntransfer einen großen Schritt vorangekommen: Noch vor einem Jahr benötigten die koreanischen Forscher 242 Eizellen bzw. 30 Embryonen (also Blastozysten), um eine einzige menschliche Stammzelllinie herzustellen. Vor allem diese mangelnde Effizienz des Verfahrens, die Tatsache, dass die große Mehrzahl der Klone frühzeitig abstirbt oder aber erhebliche Wachstumsanomalitäten aufweist, ließen am therapeutischen Potenzial dieses Verfahrens zweifeln. Mittlerweile ist es den Koreanern aber durch äußerst präzise und hoch selektive Prozeduren gelungen, in denen beispielsweise nur das beste biologische Material für die Experimente ausgewählt wurde, aus lediglich zehn Eizellen bzw. drei Blastozysten eine embryonale Stammzelllinie zu gewinnen. Damit ist zumindest eines der Argumente gegen das therapeutische Klonen – die mangelnde Effizienz des Verfahrens – hinfällig.
Trotzdem bleiben nach wie vor Unwägbarkeiten. Bereits vor drei Jahren publizierten Wissenschaftler Experimente am Mausmodell: Danach hängt die Entwicklung von Klonmäusen maßgeblich davon ab, welcher Spenderkern eingesetzt wird. Setzten die Wissenschaftler so genannte Cumulus-Zellkerne aus Ovarien ein, so wurden die Klonmäuse besonders fett. Handelte es sich um so genannte Sertoli-Zellen aus den Hoden von Mausmännchen, so starben die Mäuse dagegen zu einem ungewöhnlich frühen Zeitpunkt. Wenn aber Klontiere Anomalitäten während des Heranwachsens zeigen, muss man dann nicht auch bei den embryonalen Stammzellen, nachdem sie sich etwa zu Nerven- oder Muskelzellen entwickelt haben, mit Problemen rechnen?
Vor diesem Hintergrund gewinnt ein tieferes Verständnis der Reprogrammierung besonderes Gewicht. Die Max-Planck-Forscher konnten zeigen, dass klonierte Mausblastozysten von genetisch identischen Kernspenderzellen Unterschiede in der Genexpression zeigen, die nicht zufällig sind, sondern durch unterschiedliche Kulturbedingungen gesteuert werden: Sowohl die Rate der Blastozysten-Bildung, als auch die Verteilung der Boten-RNA (mRNA) des pluripotenten Stammzellmarkers Oct4 in den klonalen Blastozysten waren davon abhängig. Das aber bedeutet, dass der Prozess des Reprogrammierens nicht auf den Spenderkern beschränkt ist und sich auch über die ersten Zellteilungen hinaus fortsetzt.
„Unsere Beobachtungen zeigen, dass für die Entwicklung bis zum Blastozystenstadium keine vollständige Reprogrammierung notwendig ist. Für den Erfolg des Prozesses ist unter anderem der Ursprung des Spenderkerns ausschlaggebend. Dennoch können wir die Entwicklung geklonter Blastozysten und die Reprogrammierung durch die Wahl geeigneter Kulturbedingungen beeinflussen“, erklärt Michele Boiani. „Embryonale Stammzellen sind offenbar aber nicht mit der inneren Zellmasse der Blastozyste gleichzusetzen. Anhand der Oct4-Expression in der Blastozyste können wir Aussagen über die Effizienz der Gewinnung embryonaler Stammzellen machen. Es ist allerdings nicht möglich, die fötale Entwicklung geklonter Embryonen vorherzusagen, geschweige denn, sie zu verbessern.“
Media Contact
Weitere Informationen:
http://www.mpg.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Größte bisher bekannte magnetische Anisotropie eines Moleküls gemessen
An der Berliner Synchrotronstrahlungsquelle BESSY II ist es gelungen, die größte magnetische Anisotropie eines einzelnen Moleküls zu bestimmen, die jemals experimentell gemessen wurde. Je größer diese Anisotropie ist, desto besser…

Tsunami-Frühwarnsystem im Indischen Ozean
20 Jahre nach der Tsunami-Katastrophe… Dank des unter Federführung des GFZ von 2005 bis 2008 entwickelten Frühwarnsystems GITEWS ist heute nicht nur der Indische Ozean besser auf solche Naturgefahren vorbereitet….

Resistente Bakterien in der Ostsee
Greifswalder Publikation in npj Clean Water. Ein Forschungsteam des Helmholtz-Instituts für One Health (HIOH) hat die Verbreitung und Eigenschaften von antibiotikaresistenten Bakterien in der Ostsee untersucht. Die Ergebnisse ihrer Arbeit…



