Molekulare Anstandsdame entschleiert
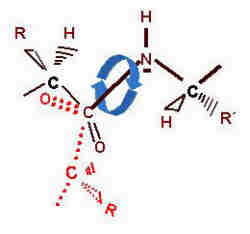
Die energetische Barriere für die Rotation um die Peptidbindung ist hoch und deswegen ist die C-N-Bindung im Vergleich zu den anderen zwei Bindungen, die das Proteinrückgrat bilden, sehr starr. Erst die Senkung der C-N-Rotationsbarriere - z.B. durch die neuentdeckte Katalyseeigenschaften des hsp70 Chaperons DnaK - ermöglicht eine leichte Umwandlung der beiden Kettenanordnungen im gezeigten Teilbereich der Polypeptidkette. <br> <br>Abb.: Max-Planck-Forschungsstelle für Enzymologie der Proteinfaltung <br>
Max-Planck-Wissenschaftler entdecken für die Proteinfaltung wichtige Enzym-Klasse / Ansatz für die Entwicklung einer neuen Art von Antibiotika
Proteine sind essentielle Lebensbausteine, ihre Funktion hängt eng von ihrer dreidimensionalen Struktur ab. Zur Vermeidung fehlerhafter Faltungen verfügen Zellen deshalb über molekulare „Anstandsdamen“, auch Chaperone genannt. Diese Helferproteine unterstützen andere Proteine bei der Faltung und tragen dazu bei, fehlerhafte Faltungen und ihre schädlichen Konsequenzen zu vermeiden. Forscher der Max-Planck-Forschungsstelle für Enzymologie der Proteinfaltung in Halle/Saale haben jetzt mit dem hsp70-Chaperon aus dem Bakterium Escherichia coli den ersten Vertreter einer neuen Enzymklasse identifiziert (Nature Structural Biology, Juni 2002), die auf enzymatischem Weg die Faltung von Protein-„Rohlingen“ beeinflussen. Diese grundlegende Entdeckung zeigt auch neue Wege, wie krankmachende Bakterien künftig über die Störung ihrer Proteinfaltung durch neuartige Antibiotika außer Gefecht gesetzt werden könnten.
Biologische Prozesse benötigen für ihren Ablauf Proteine, die zur richtigen Zeit und am richtigen Ort im Organismus in einem funktionsfähigen Zustand vorliegen müssen. Die Funktion eines Proteins und die dreidimensionale Anordnung seiner Bausteine, d.h. seine Faltung, hängen eng miteinander zusammen. Fehlerhafte Faltungen führen oft zum Funktionsverlust des Proteins oder sogar zu toxischen Faltungsprodukten. Beispiele für faltungsbedingte Leiden sind neurodegenerativen Erkrankungen wie Morbus Alzheimer oder die Prionenkrankheiten, aber auch Cystische Fibrose oder Krebs.
Die Faltung und Umstrukturierung von Polypeptiden, also Proteinen hängt wesentlich von Rotationsbewegungen um chemische Bindungen ab. Die Hallenser Max-Planck-Wissenschaftler interessieren sich deshalb besonders für Enzyme, die als Biokatalysatoren in Zellen die Rotation um die normalerweise starre Kohlenstoff-Stickstoff-Bindung im Rückgrat einer aus Aminosäuren bestehenden Polypeptidkette beschleunigen. Erstmals haben sich die Forscher dabei den Umstand zunutze gemacht, dass die spektralen Eigenschaften einiger Dipeptide vom Rotationszustand des Peptidrückgrates abhängen. Sie untersuchten Protein-Proben daher mit Hilfe der UV-Spektroskopie. In ihrem Modell-Bakterium Escherichia coli gelang es ihnen tatsächlich Enzyme zu finden, die bei Proteinen eine sehr schnelle Drehung um die Kohlenstoff-Stickstoff-Bindung bewirken.
Bisher war eine solche durch Enzyme bewirkte Rotationsbeschleunigung nur für Polypeptide bekannt, die das Stickstoffatom der Aminosäure Prolin in der rotierenden Bindung enthalten. Demgegenüber wirkt die neue Enzymklasse auf die meisten der 20 Gen-kodierten Aminosäuren. Als ersten Vertreter dieser Enzyme identifizierten die Wissenschaftler ein für die Biosynthese von Proteinen in Escherichia coli bedeutsames Chaperon, das Hitzeschockprotein DnaK.
DnaK lässt starre Bindungen nicht nur in Dipeptiden, sondern auch in längerkettigen Peptiden und in entfalteten Proteinen schneller rotieren. Dazu braucht es keine energieliefernde Zusätze wie ATP. Obwohl schon seit längerem bekannt ist, dass DnaK hilft, Falschfaltungen zu vermeiden und die Ausbeute an funktionalen Proteinen in der Zelle zu erhöhen, wussten die Forscher bisher wenig über die Wirkungsweise dieser molekularen „Anstandsdame“. Klar war, dass die Starrheit der Kohlenstoff-Stickstoff-Bindung die dreidimensionale Struktur nativer Proteine aufrechterhält und die Zahl der möglichen, energetisch günstigen Anordnungen der Aminosäuren in einer Polypeptidkette begrenzt.
In manchen Fällen, wie beim Aufrechterhalten von zellulären Funktionen unter Stressbedingungen, kann aber an bestimmten Stellen des Proteinrückgrates mehr Flexibilität erforderlich sein. DnaK bewerkstelligt dies, indem es die durch die Elektronenanordnung bedingte Starrheit der Kohlenstoff-Stickstoff-Bindung vermindert und gleichsam wie ein „Schmiermittel“ an einer vorbestimmten Stelle in der Polypeptidkette wirkt. Da dieses Enzym danach noch weitere Bindungen angreifen und ebenfalls „schmieren“ kann, vermuten die Forscher, dass dieses Enzym eine Art „Korrekturleser-Funktion“ für ungünstige Winkelkombinationen innerhalb der jeweiligen Polypeptidkette hat.
Die Hallenser Proteinchemiker haben innerhalb des DnaK-Moleküls auch den genauen Ort ausgemacht, wo die Katalyse abläuft. In weiteren Experimenten wollen sie nun die Identität der anderen Enzymproteine bestimmen, bei denen sie die gleiche katalytische Aktivität festgestellt haben, sowie andere Organismen, vor allem aber menschliches Gewebe auf das Vorkommen dieser neuen Enzymklasse testen.
Diese Forschungsergebnisse eröffnen neue Perspektiven für therapeutische Anwendungen, wie zum Beispiel bei der Suche nach niedermolekularen Wirkstoffen, mit denen man die Funktion der Faltungshelfer in krankmachenden Bakterien gezielt lahm legen kann, ohne den gleichen Prozess in menschlichen Zellen zu beeinflussen. Dies wäre ein Weg zu neuartigen Antibiotika.
Dieses Projekt wurde durch die Max-Planck-Gesellschaft und den Fonds der Chemischen Industrie gefördert
Weitere Informationen erhalten Sie von:
Dr. Cordelia Schiene-Fischer
Max-Planck-Forschungsstelle für Enzymologie der Proteinfaltung
Tel.: 03 45 – 5 52 – 28 29
Fax.: 03 45 – 5 51 – 19 72
E-Mail: schiene@enzyme-halle.mpg.de
Media Contact
Weitere Informationen:
http://www.mpg.de/Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Größte bisher bekannte magnetische Anisotropie eines Moleküls gemessen
An der Berliner Synchrotronstrahlungsquelle BESSY II ist es gelungen, die größte magnetische Anisotropie eines einzelnen Moleküls zu bestimmen, die jemals experimentell gemessen wurde. Je größer diese Anisotropie ist, desto besser…

Tsunami-Frühwarnsystem im Indischen Ozean
20 Jahre nach der Tsunami-Katastrophe… Dank des unter Federführung des GFZ von 2005 bis 2008 entwickelten Frühwarnsystems GITEWS ist heute nicht nur der Indische Ozean besser auf solche Naturgefahren vorbereitet….

Resistente Bakterien in der Ostsee
Greifswalder Publikation in npj Clean Water. Ein Forschungsteam des Helmholtz-Instituts für One Health (HIOH) hat die Verbreitung und Eigenschaften von antibiotikaresistenten Bakterien in der Ostsee untersucht. Die Ergebnisse ihrer Arbeit…



