Killer-Bakterium als lebendes Antibiotikum
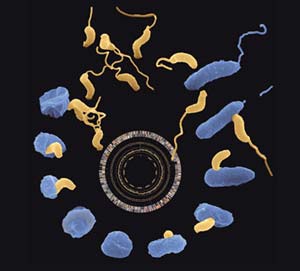
Abb. 1: Lebenszyklus des räuberischen Bakteriums Bdellovibrio bacteriovorus (gelb). Um sich vermehren zu können, braucht es andere Bakterien (blau) als Wirt. <br>Bild: Max-Planck-Institut für Entwicklungsbiologie/Rendulic, Berger und Schuster <br>
Räuberisches Bakterium kann neue, Protein-basierte antibiotische Substanzen liefern und selbst als Killer gegen Krankheitserreger wirken
Räuberische Bakterien spielen in komplexen mikrobiellen Gemeinschaften eine wichtige Rolle. Sie treten nicht nur in terrestrischen und aquatischen Ökosystemen auf, sondern konnten auch in Menschen und Tieren nachgewiesen werden. Wissenschaftler des Max-Planck-Instituts für Entwicklungsbiologie in Tübingen haben jetzt gemeinsam mit Kollegen der Universität Nottingham, England, und der Universität Bielefeld erstmals die komplette Genomsequenz des räuberischen Bakteriums Bdellovibrio bacteriovorus aufgeklärt, um jene molekularen Mechanismen zu untersuchen, die zum Einsatz kommen, wenn Bakterien andere Bakterien jagen. Erkenntnisse über diesen vermutlich viele Millionen Jahre alten Prozess können in Zukunft dazu beitragen, neue anti-mikrobielle Substanzen zu entwickeln. Diese werden nicht auf den bisher bekannten Strukturen herkömmlicher chemischer Antibiotika beruhen, sondern aus den Proteinsequenzen abgeleitet werden, die durch die Genomaufklärung von Bdellovibrio nun vorhergesagt wurden. Ferner schlagen die Wissenschaftler vor, das Bakterium Bdellovibrio selbst derart zu modifizieren, dass es als „lebendes Antibiotikum“ eingesetzt werden kann (Science 30. Januar 2004).
Ein besonders faszinierender bakterieller “ Räuber“ ist Bdellovibrio bacteriovorus. Es heftet sich an bestimmte Wirtsbakterien an, um dann in diese einzudringen. Hat sich das Bakterium erst einmal eingenistet, verzehrt es seinen Wirt von innen heraus. Durch die komplette Aufklärung des Genoms konnten die Tübinger Forscher nun den Lebenszyklus von Bdellovibrio erstmals jenen molekularen Mechanismen gegenüber stellen, die das Bakterium bei seiner einzigartigen Lebensweise einsetzt.
In einer ersten frei-lebenden Phase schwimmt Bdellovibrio mit hoher Geschwindigkeit und versucht seine Beute durch den Gebrauch seiner chemischen Rezeptoren zu orten. Ist der Räuber erst einmal mit einem potentiellen Wirt zusammengestoßen, heftet er sich an diesen reversibel an – nicht ohne sich zu versichern, ob es sich auch um eine geeignete Beute handelt. Dieser Erkennungsmechanismus wird sehr wahrscheinlich durch ein Pilus-System vermittelt, ein Multi-Funktions-Fortsatz , der von einem Pol der Bakterienzelle ausgeht. Dieses besteht aus langen Fasern, die zum einen in der Lage sind, Stoffe zu transportieren, und zum anderen von der Bdellovibrio Zelle mechanisch wieder eingeholt werden können. Auf diese Art und Weise zieht sich der Räuber zuerst an seine Beute heran, um dann in diese einzudringen. Zuvor ätzt Bdellovibrio mit einem Enzym-Cocktail, der die Lipide, Proteine und Zuckerstrukturen der Wirtszellwand zersetzt, ein Loch in die äußere Membran seiner Beute. Durch diese Öffnung nistet sich der Räuber dann in einem Kompartiment ein, das zwischen der gerade überwundenen äußeren Membran und der das Zytoplasma umschließenden inneren Membran liegt. An dieser Position kann Bdellovibrio nun verweilen, da sich die Eintrittsöffnung wieder verschließt und das Wirtsbakterium lebensfähig bleibt.
In der Regel tritt Bdellovibrio in der Wirtszelle sofort in seine Wachstumsphase ein, wofür es Aminosäuren benötigt, die es jedoch selbst nicht herstellen kann. Vielmehr erzeugt das Bakterium diese Aminosäuren und andere Nährstoffe durch den Abbau von Biopolymeren aus dem Zytoplasma seiner Wirtszelle. Auf diese Weise wird das Zytosol des Wirts völlig verzehrt, während die Bdellovibrio-Zelle sich gleichzeitig immer mehr verlängert. Sind alle Wirtsressourcen aufgebraucht, so differenziert sich diese „Mutterzelle“ in bis zu 15 neue Angriffszellen, die – wie die ursprünglich eingedrungene Zelle – wieder in der Lage sind, sich schwimmend fortzubewegen, Beute aufzuspüren und anzugreifen.
Die Analyse des Bdellovibrio Genoms hat gezeigt, dass dieser Organismus eine Vielzahl von Enzymen besitzt, die komplexe Biopolymere wie Proteine, Zucker, DNA und RNA des bakteriellen Wirts zersetzen können. In Zusammenarbeit mit anderen Forschergruppen werden die Wissenschaftler deshalb versuchen, jene Ziele in der Wirtszelle zu identifizieren, die sich in dieser Jahrmillionen alten Räuber-Beute-Beziehung zwischen Bakterien als robuste und effektive Angriffsziele herausgestellt haben. Hierbei sollen auch die in diesem Prozess zum Einsatz kommenden Enzyme und deren Wirkungsweise untersucht werden. Schon aus den jetzt vorliegenden Forschungsergebnissen ist jedoch klar, dass es sich bei diesen Angriffspunkten um zelluläre Systeme in der Wirtszelle handelt, die von den heute eingesetzten (chemischen) Antibiotika als Wirkungsort vernachlässigt werden.
Noch weiter in die Zukunft der antimikriobiellen Strategien zeigt jedoch der Vorschlag, das Raubbakterium Bdellovibrio selbst als lebendes Antibiotikum einzusetzen. Dies erscheint den Wissenschaftlern möglich, weil Bdellovibrio nicht in der Lage ist, eukaryotische und insbesondere Säugetierzellen zu befallen. Zudem konnten die Wissenschaftler zeigen, dass Bdellovibrio eine besonders schwach immunogene Oberfläche besitzt, die in Tierversuchen keine Reaktion des Immunsystems hervorruft. Diese Eigenschaften, zusammen mit der Tatsache, dass bestimmte Bdellovibrio-Stämme auf ganz bestimmte Wirtsorganismen beschränkt sind, und Bdellovibrio zudem in der Lage ist, sich in den selben Geweben zu bewegen, die von wichtigen human-pathogenen Bakterien besiedelt werden, erscheint diese Strategie sehr erfolgversprechend.
Originalveröffentlichung:
Snjezana Rendulic, Pratik Jagtap, Andrea Rosinus, Mark Eppinger, Claudia Baar, Christa Lanz, Heike Keller, Carey Lambert, Katy J. Evans, Alexander Goesmann, Folker Meyer, R. Elizabeth Sockett, Stephan C. Schuster
A Predator Unmasked: Life
Weitere Informationen erhalten Sie von:
PD Dr. Stephan C. Schuster
Max-Planck-Institut für Entwicklungsbiologie, Tübingen
Tel.: 07071 601-440 oder 0173 6639925
Fax: 07071 601-442
E-Mail: stephan.schuster@tuebingen.mpg.de
Media Contact
Weitere Informationen:
http://www.mpg.de/bilderBerichteDokumente/dokumentation/pressemitteilungen/2004/Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Größte bisher bekannte magnetische Anisotropie eines Moleküls gemessen
An der Berliner Synchrotronstrahlungsquelle BESSY II ist es gelungen, die größte magnetische Anisotropie eines einzelnen Moleküls zu bestimmen, die jemals experimentell gemessen wurde. Je größer diese Anisotropie ist, desto besser…

Tsunami-Frühwarnsystem im Indischen Ozean
20 Jahre nach der Tsunami-Katastrophe… Dank des unter Federführung des GFZ von 2005 bis 2008 entwickelten Frühwarnsystems GITEWS ist heute nicht nur der Indische Ozean besser auf solche Naturgefahren vorbereitet….

Resistente Bakterien in der Ostsee
Greifswalder Publikation in npj Clean Water. Ein Forschungsteam des Helmholtz-Instituts für One Health (HIOH) hat die Verbreitung und Eigenschaften von antibiotikaresistenten Bakterien in der Ostsee untersucht. Die Ergebnisse ihrer Arbeit…



