Selektiver Integrin-Ligand könnte helfen, Krebszellen gezielt zu bekämpfen
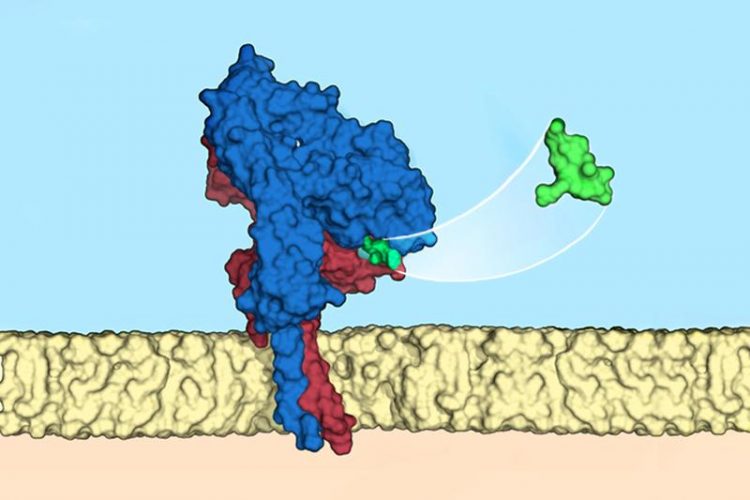
Wie ein Schlüssel passt der Ligand (grün) exakt zu einem bestimmten Integrin (blau/rot) auf der Oberfläche einer Zellmembran (beige) Bild: Francesco S. di Leva, Luciana Marinelli / Università di Napoli Federico II
Integrine sind eine der wichtigsten Verbindungen der Zelle zur Außenwelt. Sie befinden sich auf der Oberfläche der Zelle und verankern sie mit anderen Zellen oder Substanzen im Zellzwischenraum, der sogenannten „extrazellulären Matrix“. Durch diesen direkten Kontakt wird die Zelle nicht nur im Verband gehalten, sie nimmt auch Signale ihrer Umgebung wahr und kann entsprechend reagieren – zum Beispiel indem sie wächst, sich teilt oder den Zellverband verlässt.
Bindet ein Protein aus der Umgebung, ein sogenannter Ligand, an das Integrin, werden im Inneren der Zelle je nach Art des Integrins unterschiedliche Signalkaskaden in Gang gesetzt. Ohne Integrine wäre die Zelle quasi „blind“, „taub“ und „stumm“ – und somit kaum überlebensfähig.
Das Ziel: Krebszellen charakterisieren
Doch auch Krebszellen nutzen die Integrine für ihre Zwecke. Mit ihrer Hilfe gelingt es ihnen, sich aus dem Tumorgewebe zu lösen, in Blutgefäße einzudringen und schließlich in anderen Geweben, etwa in der Lunge oder im Knochen wieder Fuß zu fassen – Metastasen sind die Folge. Welche der vielen Integrin-Subtypen bei einem Tumor allerdings genau am Werk sind, ist dabei sehr individuell und kann sich von Patient zu Patient stark unterscheiden.
„Wenn man wüsste, welche Integrin-Subtypen im speziellen Krebs eines Patienten aktiv sind, könnte man diese mit entsprechenden Wirkstoffen gezielt angreifen“, erklärt Tobias Kapp, Doktorand in der Arbeitsgruppe von Professor Horst Kessler am TUM Institute for Advanced Study und an der Fakultät für Chemie der TU München. „Dafür benötigt man Verbindungen, die möglichst spezifisch an nur ein bestimmtes Integrin binden.“
Nun ist es Kessler, Kapp und seinem Kollegen Dr. Oleg Maltsev gelungen, einen solchen Liganden zu entwickeln: Eine ringförmige Verbindung, die an das Integrin alphaVbeta6 bindet, das in vielen Krebsarten vorkommt und auch bei Fibrosen eine große Rolle spielt. Es handelt sich um einen der ersten spezifischen Liganden für diesen Integrin-Typen.
Ein vielversprechender Wirkstoff
Das neue Molekül erfüllt viele Anforderungen, die an einen potentiellen medizinischer Wirkstoff gestellt werden: Es dockt hoch selektiv nur an das alphaVbeta6-Integrin an – eine wichtige Voraussetzung um es später einmal als Basis für Medikamente mit möglichst wenigen Nebenwirkungen einzusetzen.
Außerdem bindet es bereits bei vergleichsweise geringen Konzentrationen einen Großteil der alphaVbeta6-Integrine, könnte also bereits in geringen Mengen wirken. Weiterhin ist es auf Grund seiner zyklischen Struktur beständig und wird, anders als in der Natur vorkommende Integrin-Liganden, im Blutplasma nur langsam abgebaut.
Und noch eine wichtige Eigenschaft bringt der neue Ligand mit: Eine seiner Aminosäuren, ein Lysin, kann für eine „Kopplung“ verwendet werden, mit deren Hilfe weitere Substanzen an die Verbindung angehängt werden können. „Dies ist von großer Bedeutung wenn man den Liganden auch als Diagnostikum verwenden möchte“, erklärt Kapp. „Man kann dann beispielsweise eine Substanz anhängen, die mit Hilfe medizinischer Bildgebungsgeräte sichtbar wird.“
Auf diese Weise ließe sich der Tumor charakterisieren und anschließend durch eine gezielte Therapie bekämpfen.“ Würde dies in Zukunft gelingen, wäre das ein großer Fortschritt gegenüber konventionellen Krebstherapien, die meist sehr breit angelegt sind und auch gesunde Zellen schädigen.
Schritt für Schritt zum optimalen Bindungspartner
Als Vorlage für den neuen Liganden benutzten die Wissenschaftler ein Protein des Maul-und-Klauenseuche-Virus. Dieser natürliche alphaVbeta6-Ligand bindet mit Hilfe einer Alpha-helikalen Struktur an das Integrin,. Die Forscher bauten die Helix mit einer kleinen, aus neun Aminosäuren bestehenden Ringstruktur nach.
In einem mehrstufigen Auswahlprozess testeten sie eine Vielzahl an Variationen, bis das geeignetste Molekül gefunden war. Dazu nutzten sie auch eine selbst entwickelte neue Technik: Hierbei wird die Seitenkette der Aminosäure Arginin als eine Art molekularer Schalter benutzt. Dieser beeinflusst, an welchen Integrin-Subtyp der Ligand selektiv bindet.
„Wir kennen nun die Form des Schlosses und wir wissen, wie wir genau passende Schlüssel herstellen können“, sagt Professor Kessler. „Damit öffnet sich die Tür zu einer personalisierten Medizin, bei der wir patientenspezifisch gezielt gegen Tumorzellen vorgehen können.“
Die Ergebnisse entstanden im Rahmen einer Forschungskooperation zwischen der Fakultät für Chemie und dem Klinikum rechts der Isar der TU München, der Università di Napoli Federico II und der Secondo Università di Napoli. Die Arbeiten wurden durch ein Reinhard Koselleck Projekt und über den Exzellenzcluster Center for Integrated Protein Research Munich (CIPSM) von der Deutschen Forschungsgemeinschaft (DFG) gefördert. Die Struktur des Integrin-Liganden wurde am Bayerischen NMR-Zentrum auf dem Campus Garching bestimmt.
Publikationen:
O. V. Maltsev, U. K. Marelli, T. G. Kapp, F. Saverior Di Leva, S. Di Maro, M. Nieberler, U. Reunig, M. Schwaiger, E. Novellino, L. Marinelli, H. Kessler, Stable Peptides Instead of Stapled Peptides: Highly Potent αvβ6- Selective Integrin Ligands, Angewandte Chemie, DOI: 10.1002/ange.201508709
T. G. Kapp, M. Fottner, O. V. Maltsev, H. Kessler, Small cause, great impact – modification of the guanidine group in RGD controls integrin subtype selectivity, Angewandte Chemie, DOI: 10.1002/ange.201508713
Kontakt:
Prof. Dr. Horst Kessler
Institute for Advanced Study, Technische Universität München
Lichtenbergstr. 4, 85747 Garching, Germany
Tel.: +49-89 289 13300 – E-Mail: kessler@tum.de
http://go.tum.de/524040
http://go.tum.de/106019
http://onlinelibrary.wiley.com/wol1/doi/10.1002/ange.201508709/full
http://onlinelibrary.wiley.com/wol1/doi/10.1002/anie.201508713/full
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Spitzenforschung in der Bioprozesstechnik
Das IMC Krems University of Applied Sciences (IMC Krems) hat sich im Bereich Bioprocess Engineering (Bioprozess- oder Prozesstechnik) als Institution mit herausragender Expertise im Bereich Fermentationstechnologie etabliert. Unter der Leitung…

Datensammler am Meeresgrund
Neuer Messknoten vor Boknis Eck wurde heute installiert. In der Eckernförder Bucht, knapp zwei Kilometer vor der Küste, befindet sich eine der ältesten marinen Zeitserienstationen weltweit: Boknis Eck. Seit 1957…

Rotorblätter für Mega-Windkraftanlagen optimiert
Ein internationales Forschungsteam an der Fachhochschule (FH) Kiel hat die aerodynamischen Profile von Rotorblättern von Mega-Windkraftanlagen optimiert. Hierfür analysierte das Team den Übergangsbereich von Rotorblättern direkt an der Rotornabe, der…



