Blutplättchen verstärken die Immunantwort
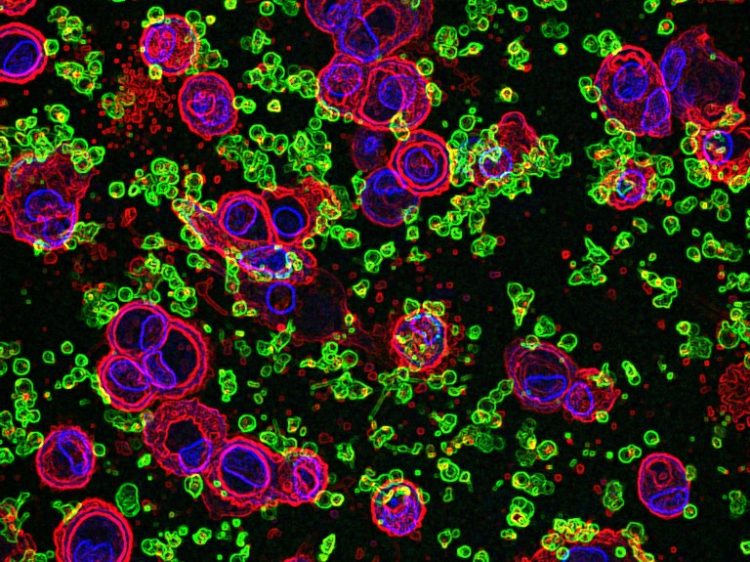
Blutplättchen (grün) tragen zur Aktivierung von Inflammasomen in menschlichen Makrophagen (rot; Zellkerne: blau) bei und somit zu einer vermehrten IL-1-Produktion. © künstlerische Darstellung (basierend auf mikroskopischen Aufnahmen): B. Franklin / L. Ribeiro/UKB
Lange Zeit schien die Rolle der Blutplättchen klar: Bei Verletzungen heften sie sich an die Wunde und verkleben zudem untereinander. Die Blutung kommt so rasch zum Erliegen.
Dieser Wundverschluss-Mechanismus funktioniert schnell und effizient. Andere Funktionen schrieb man seinen Protagonisten aber nicht zu.
Seit einigen Jahren beginnt sich dieses Bild deutlich zu wandeln: Demnach sollen die winzigen Zellen – jede von ihnen hat etwa die Größe eines Darmbakteriums – auch wichtige Funktionen im Immunsystem übernehmen.
Die aktuelle Studie der Universitäten Bonn und Sao Paulo gibt dieser These Rückenwind: Demnach sorgen Blutplättchen dafür, dass die weißen Blutzellen (die Leukozyten) deutlich mehr Entzündungsbotenstoffe ausschütten.
„Möglicherweise trägt dieser Effekt zu dem oft schweren Verlauf so genannter Autoimmunkrankheiten bei“, erklärt Prof. Dr. Bernardo Franklin vom Institut für angeborene Immunität am Universitätsklinikum Bonn. „Das sind Erkrankungen, bei denen die Immunabwehr körpereigenes Gewebe attackiert und zerstört.“
Blutplättchen wirken kontaktlos
Die Wissenschaftler nahmen in ihrer Studie einen wichtigen Immun-Mechanismus unter die Lupe: die Bildung und Aktivierung des Inflammasoms NLRP3. Inflammasome sind molekulare Maschinen, die aus einer Reihe verschiedener Proteine bestehen. Sie sind unter anderem dazu in der Lage, inaktive Entzündungsbotenstoffe in ihre aktive Form umzuwandeln. Einer davon ist das Interleukin IL-1.
Wenn Zellen IL-1 ausschütten, rufen sie damit andere Immunzellen zur Hilfe und leiten so eine starke Entzündungsreaktion ein. Da diese dem Körper auch gefährlich werden kann, wird die Aktivität der Inflammasome – und damit auch die Bildung von IL-1 – streng reguliert.
„Wir konnten nun zeigen, dass Blutplättchen in diese Regulierung eingreifen“, erklärt Franklins Mitarbeiter Dr. Lucas Secchim Ribeiro: „Sie sorgen dafür, dass bestimmte weiße Blutzellen – die Makrophagen und die neutrophilen Granulozyten – mehr Inflammasome bilden.“
Dazu scheinen sie einen ganzen Cocktail aus Substanzen auszuschütten, die zu den weißen Blutzellen diffundieren. Dort sorgen sie unter anderem dafür, dass bestimmte Gene, die für den Bau der Inflammasome benötigt werden, häufiger abgelesen werden.
Blutplättchen sind keine Bösewichte
Für diesen Effekt ist es nicht nötig, dass die Blutplättchen mit den Makrophagen oder Granulozyten direkt Kontakt aufnehmen. Stattdessen geben sie ihre Wirkstoffe in die Umgebung ab, also zum Beispiel in das Blutplasma. „Wir haben aus Menschen isolierte Blutplättchen im Labor inkubiert und dann das Kulturmedium abfiltriert“, erklärt Dr. Ribeiro.
„Als wir von diesem Filtrat einige Tropfen zu weißen Blutzellen aus Menschen gegeben haben, wurden in ihnen die Bildung der Inflammasome und die IL-1-Produktion deutlich angekurbelt.“ Welche von den Blutplättchen abgegebenen Substanzen dafür genau verantwortlich sind, ist noch nicht abschließend geklärt.
Der Effekt korrespondiert jedoch mit Beobachtungen bei Malaria-Patienten: Je mehr Blutplättchen diese haben, desto höher ist bei ihnen die IL-1-Konzentration im Blutplasma. Die Wissenschaftler verringerten zudem experimentell in Mäusen die Anzahl der Blutplättchen. Die Tiere schütteten daraufhin nach Injektion bakterieller Zellwandbestandteile deutlich weniger IL-1 aus.
Da IL-1 Entzündungen fördert, kann der Botenstoff den Verlauf von Autoimmun-Krankheiten deutlich verschlechtern. Dennoch seien Blutplättchen keine Bösewichte, wehrt sich Prof. Franklin gegen eine zu einseitige Sichtweise:
Sie greifen auch noch auf anderen Wegen in die Immunabwehr ein und können so beispielsweise verhindern, dass nach einer Infektion eine lebensbedrohliche Sepsis entsteht. Unabhängig davon könnten die Ergebnisse den Weg zu neuen Therapien gegen Erkrankungen wie Rheuma oder Diabetes ebnen.
Mechanismus wird in Zellkulturen nicht sichtbar
Eine wichtige Botschaft der aktuellen Studie ist aber eher übergeordneter Natur: Wenn man Blutzellen isoliert in Kultur nimmt, verhalten sie sich dort oft ganz anders als in ihrem natürlichen Umfeld, in dem sie mit zahlreichen anderen Zellen kommunizieren.
„Experimente im Reagenzglas gewähren daher keinen vollständigen Einblick in die Prozesse, die im Körper stattfinden“, betont Prof. Franklin. „Dennoch basieren 90 Prozent der Forschungsprojekte auf ihnen – eine Tatsache, die wir überdenken sollten.“ Auch die Blutplättchen zeigen schließlich ihre wichtige Immunfunktion nur im Konzert mit den weißen Blutzellen.
Prof. Dr. Bernardo Franklin
Institut für angeborene Immunität
Universitätsklinikum Bonn
Tel. +49 228/287-51981
E-Mail: franklin@uni-bonn.de
Verena Rolfes, Lucas Secchim Ribeiro, Ibrahim Hawwari, Lisa Böttcher, Nathalia Rosero, Salie Maasewerd, Marina Lima Silva Santos, Tomasz Próchnicki, Camila Meirelles de Souza Silva, Carlos Wagner de Souza Wanderley, Maximilian Rothe, Susanne V. Schmidt, H. James Stunden, Damien Bertheloot, Magali Noval Rivas, Cor Jesus Fontes, Luzia Helena Carvalho, Fernando de Queiroz Cunha, Eicke Latz, Moshe Arditi und Bernardo Simoes Franklin: Platelets fuel the inflammasome activation of innate immune cells; Cell Reports, DOI: https://doi.org/10.1016/j.celrep.2020.107615
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Sensoren für „Ladezustand“ biologischer Zellen
Ein Team um den Pflanzenbiotechnologen Prof. Dr. Markus Schwarzländer von der Universität Münster und den Biochemiker Prof. Dr. Bruce Morgan von der Universität des Saarlandes hat Biosensoren entwickelt, mit denen…

Organoide, Innovation und Hoffnung
Transformation der Therapie von Bauchspeicheldrüsenkrebs. Bauchspeicheldrüsenkrebs (Pankreaskarzinom) bleibt eine der schwierigsten Krebsarten, die es zu behandeln gilt, was weltweite Bemühungen zur Erforschung neuer therapeutischer Ansätze anspornt. Eine solche bahnbrechende Initiative…

Leuchtende Zellkerne geben Schlüsselgene preis
Bonner Forscher zeigen, wie Gene, die für Krankheiten relevant sind, leichter identifiziert werden können. Die Identifizierung von Genen, die an der Entstehung von Krankheiten beteiligt sind, ist eine der großen…



