Grundlagen der Funktionen von Glutaredoxin-Proteinen im Eisenstoffwechsel und der Signalübertragung aufgeklärt
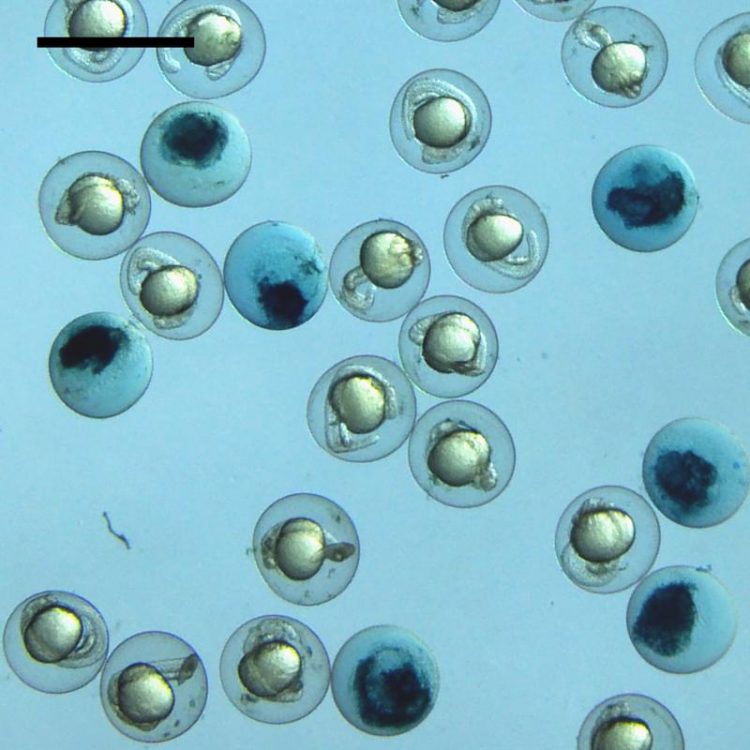
Das Bild zeigt Eier von Zebrafischen während der Entwicklung. Ein Verlust des Glutaredoxin 5 führt zum Absterben während der Entwicklung (dunkle Eier). Dieser Effekt kann nur durch Glutaredoxine kompensiert werden, die im Eisenstoffwechsel aktiv sind. Foto: Carsten Berndt
Die Erkenntnisse sind wichtig, um den Energiestoffwechsel in Zellen sowie Erkrankungen wie Krebs, multiple Sklerose oder Morbus Parkinson besser zu verstehen. Die Ergebnisse wurde in der Zeitschrift Nature Communications (DOI: 10.1038/s41467-020-17323-0) veröffentlicht.
Die zwei Protein-Klassen der Glutaredoxin-Familie kommen in nahezu allen Lebewesen vor. Beide Klassen sind wichtig für den Energiestoffwechsel in Zellen.
Die Proteine der ersten Klasse (CGFS-Typ) sind unentbehrlich im zellulären Eisenstoffwechsel. Ist diese Klasse nicht mehr voll funktionsfähig, so führt dies zu einem Verlust wichtigster Eisen-Kofaktoren wie beispielsweise das Hämoglobin.
Hämoglobin wird für den Sauerstofftransport gebraucht. Die Proteine der zweiten Klasse (CxxC/S-Typ) sind Oxidoreduktasen. Sie übertragen Elektronen und sind unter anderem unentbehrlich für die Gehirnentwicklung. Funktion und Aktivität der beiden Klassen ist also sehr unterschiedlich, und das obwohl beide Klassen eine sehr ähnliche räumliche Struktur haben und auch beide den Kofaktor Glutathion binden können.
„Beide Proteine beeinflussen das Zellenwachstum. Wenn wir die Funktion der beiden Klassen besser verstehen, dann ergeben sich daraus neue Ansätze, um beispielsweise das Wachstum von Krebszellen einzudämmen und so krebskranken Menschen zu helfen. Wollen wir auf der anderen Seite neurodegenerative Erkrankungen wie beispielsweise multiple Sklerose oder Morbus Parkinson in ihrem Verlauf abschwächen, dann können wir die Erkenntnisse dafür nutzen, das Wachstum von Nervenzellen anzuregen. Das entscheidende Schlüsselelement dafür ist eine Loop-Struktur vor dem aktiven Zentrum der beiden Protein-Klassen,“ berichtet Christopher Horst Lillig vom Institut für Medizinische Biochemie und Molekularbiologie der Universitätsmedizin Greifswald http://www2.medizin.uni-greifswald.de/biochemie/index.php?id=478.
Diese Loop- oder auch Schleifen-Struktur, die sich am aktiven Zentrum der beiden Protein-Klassen befindet, hat das internationale Forschungsteam nun durch gezieltes Protein-Engineering zweier humaner Vertreter der Glutaredoxine untersucht.
Beim Protein-Engineering wurden die entscheidenden Loop-Strukturen der beiden Protein-Klassen gegeneinander ausgetauscht. Dadurch haben sich auch die Funktionen und Aktivitäten der beiden Proteine umgekehrt. Die identifizierten Strukturen sind dafür verantwortlich, dass die beiden Protein-Klassen unterschiedlich mit ihrem gemeinsamen Kofaktor Glutathion wechselwirken.
Das wiederum bestimmt deren grundsätzlich unterschiedlichen Funktionen. Die gewonnenen Erkenntnisse helfen, Prozesse in Zellen sowie deren Fehlfunktionen besser zu verstehen.
Weitere Informationen
Der Begriff Protein-Engineering beschreibt die Konstruktion und Herstellung von Proteinen mit dem Zweck, ihre Eigenschaften zu verändern oder zu optimieren. Dies kann durch rationales Design geschehen (wie hier) oder durch gerichtete Evolution.
Trnka D*., Engelke A.*, Gellert M.*, Moseler A., Hossain M.F., Lindenberg T., Pedroletti L., Odermatt B., de Souza J., Bronowska A., Dick T., Mühlenhoff U., Meyer A., Berndt C., Lillig C.H. (2020): „Molecular basis for the distinct functions of redox-active and FeS-transfering glutaredoxins,“ in: Nature Communications. DOI: 10.1038/s41467-020-17323-0
* Diese Autoren haben gleichermaßen zur Veröffentlichung beigetragen.
Förderung: Deutsche Forschungsgemeinschaft. Förderkennzeichen: BE 3259/5-1, BE 3259/5-2, BE 3259/6-1, DI 731/3-2, GRK1947-A1, LI 984/4-1, ME 1567/9-1, ME 1567/9-2, ME 1567/13-1. http://www.dfg.de/
FOTOS:
Das Bild zeigt Eier von Zebrafischen während der Entwicklung. Ein Verlust des Glutaredoxin 5 führt zum Absterben während der Entwicklung (dunkle Eier). Dieser Effekt kann nur durch Glutaredoxine kompensiert werden, die im Eisenstoffwechsel aktiv sind. – Foto: Carsten Berndt
Bindung der Kofaktoren Glutathion (GSH) in den beiden Klassen der Glutaredoxine (linke Seite). Diese unterschiedliche Bindung hat eine große Änderung der 3-dimensionalen Struktur zur Folge (rechte Seite), welche die unterschiedlichen Funktionen der Proteine bestimmt. – Grafik: Christopher Horst Lillig
Foto und Grafik können für redaktionelle Zwecke im Zusammenhang mit dieser Medieninformation kostenlos heruntergeladen und genutzt werden. Dabei ist der Name des Bildautors zu nennen. Download http://www.uni-greifswald.de/pressefotos
Ansprechpartner an der Universitätsmedizin Greifswald
PD Dr. Dr. Christopher Horst Lillig
Institut für Medizinische Biochemie und Molekularbiologie
Ferdinand-Sauerbruch-Straße, 17475 Greifswald
Telefon 03834 86 5431 (oder 86 5407)
lilligchristopherhorst@med.uni-greifswald.de
presse@lillig.de
http://www.lillig.de
Twitter: @RCOF8
Media Contact
Alle Nachrichten aus der Kategorie: Medizin Gesundheit
Dieser Fachbereich fasst die Vielzahl der medizinischen Fachrichtungen aus dem Bereich der Humanmedizin zusammen.
Unter anderem finden Sie hier Berichte aus den Teilbereichen: Anästhesiologie, Anatomie, Chirurgie, Humangenetik, Hygiene und Umweltmedizin, Innere Medizin, Neurologie, Pharmakologie, Physiologie, Urologie oder Zahnmedizin.
Neueste Beiträge

Selen-Proteine …
Neuer Ansatzpunkt für die Krebsforschung. Eine aktuelle Studie der Uni Würzburg zeigt, wie ein wichtiges Enzym in unserem Körper bei der Produktion von Selen-Proteinen unterstützt – für die Behandlung von…

Pendler-Bike der Zukunft
– h_da präsentiert fahrbereiten Prototyp des „Darmstadt Vehicle“. Das „Darmstadt Vehicle“, kurz DaVe, ist ein neuartiges Allwetter-Fahrzeug für Pendelnde. Es ist als schnelle und komfortable Alternative zum Auto gedacht, soll…

Neuartige Methode zur Tumorbekämpfung
Carl-Zeiss-Stiftung fördert Projekt der Hochschule Aalen mit einer Million Euro. Die bisherige Krebstherapie effizienter gestalten bei deutlicher Reduzierung der Nebenwirkungen auf gesundes Gewebe – dies ist das Ziel eines Projekts…



