Lichtgesteuertes An- und Ausschalten von DNA-Funktionen
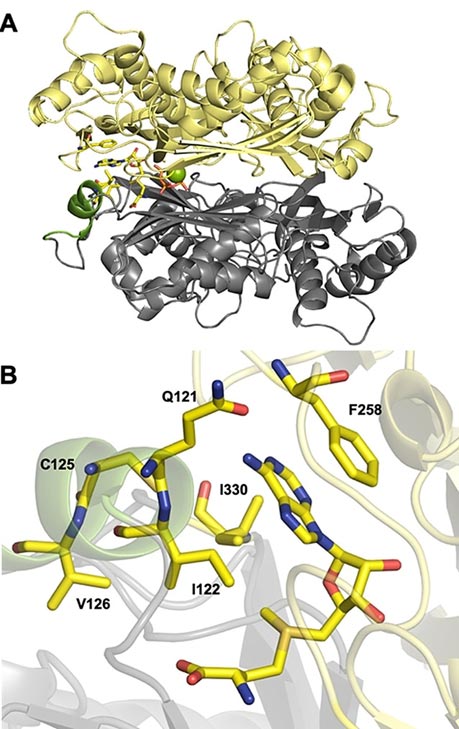
Engineering der ChMAT für Aktivität mit Benzyl‐ (1 d) und 2‐Nitrobenzyl‐d,l‐Homocystein (1 a). A) Gesamtstruktur der WT‐ChMAT (4ODJ). Der flexible “Gating‐Loop” ist grün dargestellt. Die Magnesium‐Ionen sind als grüne Kugeln dargestellt. B) Hydrophobe “Tasche”, die den Methylrest von AdoMet umgibt (als Stäbchen dargestellt). Die Reste I122, I330, V126 und C125, welche das aktive Zentrum bilden, sowie Q121 und F258, die in direkter Wechselwirkung mit der Adenineinheit stehen, sind ebenfalls als Stäbchen dargestellt.
https://onlinelibrary.wiley.com/doi/10.1002/ange.202012623
Biochemikerinnen und Biochemiker der Westfälischen Wilhelms-Universität (WWU) Münster haben eine neue Strategie entwickelt, um die biologischen Funktionen von DNA (Desoxyribonukleinsäure) mit Hilfe von Licht zu steuern und dadurch Prozesse, die in der Zelle ablaufen, zu verstehen. Die Ergebnisse sind jetzt im Fachmagazin „Angewandte Chemie“ erschienen.
Die DNA (Desoxyribonukleinsäure) bildet die Grundlage des Lebens auf der Erde. Die Funktion der DNA ist die Speicherung von allen Erbinformationen, die ein Organismus zur Entwicklung, Funktion und Reproduktion benötigt. Im Wesentlichen handelt es sich um eine biologische Gebrauchsanweisung, die in jeder Zelle zu finden ist. Biochemikerinnen und Biochemiker der Westfälischen Wilhelms-Universität Münster (WWU) haben jetzt eine neue Strategie entwickelt, um die biologischen Funktionen von DNA mit Hilfe von Licht zu steuern. Das ermöglicht den Wissenschaftlern, die unterschiedlichen Prozesse, die in der Zelle ablaufen, besser zu verstehen und zu kontrollieren. Die Ergebnisse sind im Fachmagazin „Angewandte Chemie“ erschienen.
Hintergrund und Methodik
Die Zellfunktionen hängen von speziellen Molekülen ab, den Enzymen. Enzyme sind Proteine, die an chemischen Reaktionen in der Zelle beteiligt sind. Sie helfen dabei, Stoffwechselprodukte zu synthetisieren, Kopien der DNA-Moleküle anzufertigen, Energie für Zellaktivitäten aufzubereiten, die DNA zu verändern und bestimmte Moleküle abzubauen. Um diese Funktionen besser zu verstehen und nachzuverfolgen, verwendete das Forscherteam um Prof. Dr. Andrea Rentmeister vom Institut für Biochemie der WWU eine sogenannte enzymatische Kaskadenreaktion: eine Reaktionsabfolge von mehreren aufeinanderfolgenden Reaktionsschritten, an denen unterschiedliche Enzyme beteiligt sind. Diese ermöglicht es sogenannte Photoschutzgruppen – dabei handelt es sich um chemische Gruppen, welche durch Bestrahlung mit Licht wieder entfernt werden können – auf DNA zu übertragen.
Bisherige Studien zeigten, dass mit diesem Verfahren nur kleine Reste (beispielsweise Methylgruppen) sehr selektiv auf DNA, RNA (Ribonukleinsäure) oder Proteine übertragen werden können. „Durch unsere Arbeit ist es nun möglich, größere Reste beziehungsweise Modifikationen wie die genannten Photoschutzgruppen zu übertragen“, erklärt Nils Klöcker, einer der Erstautoren der Studie und Doktorand am Institut für Biochemie. In Zusammenarbeit mit dem Strukturbiologen Prof. Dr. Daniel Kümmel, ebenfalls vom Institut für Biochemie, konnte sie außerdem die Grundlage für die veränderte Aktivität auf molekularer Ebene klären.
Mit Hilfe des sogenannten Proteins-Engineerings, einer Methode, für die im Jahr 2018 der Nobelpreis verliehen wurde, veränderten die münsterschen Wissenschaftler ein Enzym der Kaskade, so dass das lichtgesteuerte „An“- und „Ausschalten“ von DNA-Funktionen möglich wird. Durch Protein-Design gelang es, das Substratspektrum von Enzymen, in diesem Fall Methionin-Adenosyl-Transferasen (MATs) zu erweitern.
In dieser Arbeit untersuchten die Wissenschaftler zwei MATs. Die Modifikationen bieten einen Ausgangspunkt, um auch weitere MATs mit erweitertem Substratspektrum zu entwickeln. „Die Kombination dieser MATs mit anderen Enzymen hat Potenzial für zukünftige zelluläre Anwendungen. Das ist ein wichtiger Schritt für die Implementierung von in situ generierten unnatürlichen Substraten für andere Enzyme in epigenetischen Studien“, sagt Andrea Rentmeister.
Finanzierung
Die Studie erhielt finanzielle Unterstützung durch die Deutsche Forschungsgemeinschaft (DFG), den Europäischen Forschungsrat (ERC) und das Netzwerk „IRTG Münster-Toronto“.
Wissenschaftliche Ansprechpartner:
Prof. Dr. Andrea Rentmeister
Institut für Biochemie
Westfälische Wilhelms-Universität (WWU) Münster
Tel: +49 251 83-33204
Mail: a.rentmeister@uni-muenster.de
Originalpublikation:
Freideriki Michailidou, Nils Klöcker, Nicolas Cornelissen, Rohit K. Singh, Aileen Peters, Anna Ovcharenko, Daniel Kümmel, Andrea Rentmeister (2020). Engineered SAM synthetases for enzymatic generation of AdoMet analogs with photocaging groups and reversible DNA modification in cascade reactions. Angewandte Chemie Int. Ed.; DOI: 10.1002/anie.202012623
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Größte bisher bekannte magnetische Anisotropie eines Moleküls gemessen
An der Berliner Synchrotronstrahlungsquelle BESSY II ist es gelungen, die größte magnetische Anisotropie eines einzelnen Moleküls zu bestimmen, die jemals experimentell gemessen wurde. Je größer diese Anisotropie ist, desto besser…

Tsunami-Frühwarnsystem im Indischen Ozean
20 Jahre nach der Tsunami-Katastrophe… Dank des unter Federführung des GFZ von 2005 bis 2008 entwickelten Frühwarnsystems GITEWS ist heute nicht nur der Indische Ozean besser auf solche Naturgefahren vorbereitet….

Resistente Bakterien in der Ostsee
Greifswalder Publikation in npj Clean Water. Ein Forschungsteam des Helmholtz-Instituts für One Health (HIOH) hat die Verbreitung und Eigenschaften von antibiotikaresistenten Bakterien in der Ostsee untersucht. Die Ergebnisse ihrer Arbeit…



