Ein ausgebremster Bremser
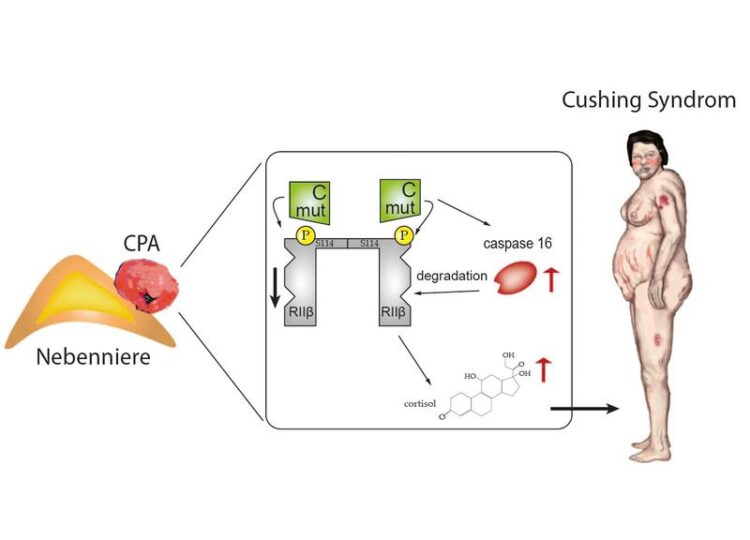
Bei einer Nebenniere mit eine gutartige Nebennierenadenom (links) ist der dem Protein-Kinase-A-Signalweg verändert (Mitte). Die Betroffenen entwickeln in der Folge die typischen Cushing-Syndrom-Merkmale
Illustration: Dr. Isabel Weigand
Eine Genmutation ist für viele Fälle des Cushing-Syndroms verantwortlich. Wie ein Team des Würzburger Uniklinikums jetzt zeigen konnte, trägt sie durch ihr Eingreifen an einer zentralen Stelle in Nebennierenzellen zu dem krankhaften Cortisol-Anstieg bei.
Von außen betrachtet, sind die Symptome klar: Menschen, die an einem endogenen Cushing-Syndrom erkrankt sind, fallen durch ihr bauchbetontes Übergewicht auf, ihr Gesicht ist rund, der Nacken kräftig. Klar sind auch die medizinischen Parameter, die mit dieser Krankheit einhergehen: Bluthochdruck, eine Muskelschwäche, Diabetes und eine erhöhte Anfälligkeit für Infekte sind die klassischen Begleiterscheinungen.
Weniger klar waren bislang die molekularen Ursachen des endogenen Cushing-Syndroms. Wissenschaftlerinnen und Wissenschaftlern der Universität und des Universitätsklinikums Würzburg (UKW) ist es bereits vor einigen Jahren gelungen, eine Mutation zu identifizieren, die sich als wesentlich für die Krankheitsentwicklung erwiesen hat. Jetzt ist es gelungen den genauen Wirkmechanismus noch etwas weiter aufzuklären. Federführend dabei waren Dr. Isabel Weigand, Professor Martin Fassnacht und Dr. Silviu Sbiera aus der Endokrinologie am UKW. In der aktuellen Ausgabe der Fachzeitschrift Science Advances haben sie die Ergebnisse ihrer Arbeit veröffentlicht.
Gutartige Tumore der Nebenniere sind der Auslöser
„Eine Ursache für das endogene Cushing-Syndrom sind Cortisol-produzierende gutartige Tumore der Nebenniere“, erklärt Martin Fassnacht. Wie frühere Studien zeigen, sind in gut 35 bis 60 Prozent aller Fälle genetische Veränderungen in den Tumorzellen der verantwortliche Faktor. Sie sorgen für Veränderungen in einem bestimmten Signalweg, dem Protein-Kinase-A-Signalweg – konkret in der katalytischen Untereinheit Cα.
Was bisher nicht bekannt war: „Diese Mutation beeinflusst den Signalweg auf weiteren, zusätzlichen Ebenen“, erklärt Dr. Silviu Sbiera. Und Dr. Isabel Weigand, Erstautorin der Studie ergänzt: „Unbekannt war auch die Tatsache, dass eine der vier regulatorischen Untereinheiten der Protein-Kinase-A die Cortisolsekretion in diesen Tumoren hemmen kann“.
Eine Genmutation steht am Anfang
Wie das Team aus der Endokrinologie zeigen konnte, setzen die Mutationen in den Tumorzellen einen verhängnisvollen Prozess in Gang: Die Zellen exprimieren verstärkt eine Protease, die sogenannte Caspase16. Diese Protease wiederum erkennt an ihrem „Kann weg“-Vermerk die regulatorische Untereinheit, die die Cortisolsekretion im Normalfall hemmt. In der Folge wird diese, in der Fachsprache RIIβ genannte Untereinheit von der Zelle verstärkt abgebaut. Eine wesentliche Bremse der Cortisolsekretion fällt damit aus.
„Wir konnten zeigen, dass RIIβ einen hemmenden Effekt auf die Cortisolsekretion in Nebennierenzellen hat und dass die Caspase16, welche bislang lediglich als Pseudogen beschrieben war, für den Abbau der RIIβ verantwortlich ist“, fasst Silviu Sbiera die wesentlichen Ergebnisse der Studie zusammen. Als Pseudogene bezeichnet die Wissenschaft Gene, von denen nicht bekannt ist, welche Proteinprodukte sie kodieren. Die jetzt veröffentlichten Ergebnisse legen somit den Schluss nahe, dass Caspase16 fälschlicherweise als Pseudogen klassifiziert wurde.
Die neuen Erkenntnisse können nach Ansicht der Wissenschaftler dazu beitragen, neue Therapien gegen das Cushing-Syndrom zu entwickeln. Ziel ist es, den Abbau der regulatorischen Untereinheit IIβ zu verhindern. Darüber hinaus schlagen sie vor, das verantwortliche Gen weiter zu erforschen und das von ihm kodierte, bislang relativ unbekannte Protein besser zu charakterisieren.
Förderung
Diese Studie wurde unterstützt aus Mitteln des IZKF Würzburg, des ERA-NET „E-Rare“, der Else-Kröner-Fresenius-Stiftung, der Deutschen Forschungsgemeinschaft sowie der Graduate School of Life Sciences der Uni Würzburg.
Wissenschaftliche Ansprechpartner:
Dr. Isabel Weigand, LMU Klinikum, T: +49 89 44 00 57 59 47 59 4
isabel.weigand@med.uni-muenchen.de
PD. Dr. Silviu Sbiera, Leiter der Forschungsabteilung der Endokrinologie an der Universitätsklinikum Würzburg, T: +49 931 201 39702, Sbiera_S@ukw.de
Prof. Dr. Martin Fassnacht, Leiter des Lehrstuhls Endokrinologie & Diabetologie, Universitätsklinikum Würzburg, T: +49 931 201-39021, Fassnacht_M@ukw.de
Originalpublikation:
PKA Cα subunit mutation triggers caspase-dependent RIIβ subunit degradation via Ser114 phosphorylation. Isabel Weigand, Cristina L. Ronchi, Jens T. Vanselow, Kerstin Bathon, Kerstin Lenz, Sabine Herterich, Andreas Schlosser, Matthias Kroiss, Martin Fassnacht, Davide Calebiro, Silviu Sbiera. Science Advances, DOI: 10.1126/sciadv.abd4176
http://www.uni-wuerzburg.de
Media Contact
Alle Nachrichten aus der Kategorie: Studien Analysen
Hier bietet Ihnen der innovations report interessante Studien und Analysen u. a. aus den Bereichen Wirtschaft und Finanzen, Medizin und Pharma, Ökologie und Umwelt, Energie, Kommunikation und Medien, Verkehr, Arbeit, Familie und Freizeit.
Neueste Beiträge

Spitzenforschung in der Bioprozesstechnik
Das IMC Krems University of Applied Sciences (IMC Krems) hat sich im Bereich Bioprocess Engineering (Bioprozess- oder Prozesstechnik) als Institution mit herausragender Expertise im Bereich Fermentationstechnologie etabliert. Unter der Leitung…

Datensammler am Meeresgrund
Neuer Messknoten vor Boknis Eck wurde heute installiert. In der Eckernförder Bucht, knapp zwei Kilometer vor der Küste, befindet sich eine der ältesten marinen Zeitserienstationen weltweit: Boknis Eck. Seit 1957…

Rotorblätter für Mega-Windkraftanlagen optimiert
Ein internationales Forschungsteam an der Fachhochschule (FH) Kiel hat die aerodynamischen Profile von Rotorblättern von Mega-Windkraftanlagen optimiert. Hierfür analysierte das Team den Übergangsbereich von Rotorblättern direkt an der Rotornabe, der…



