Scharfer Blick in die Muskelzelle
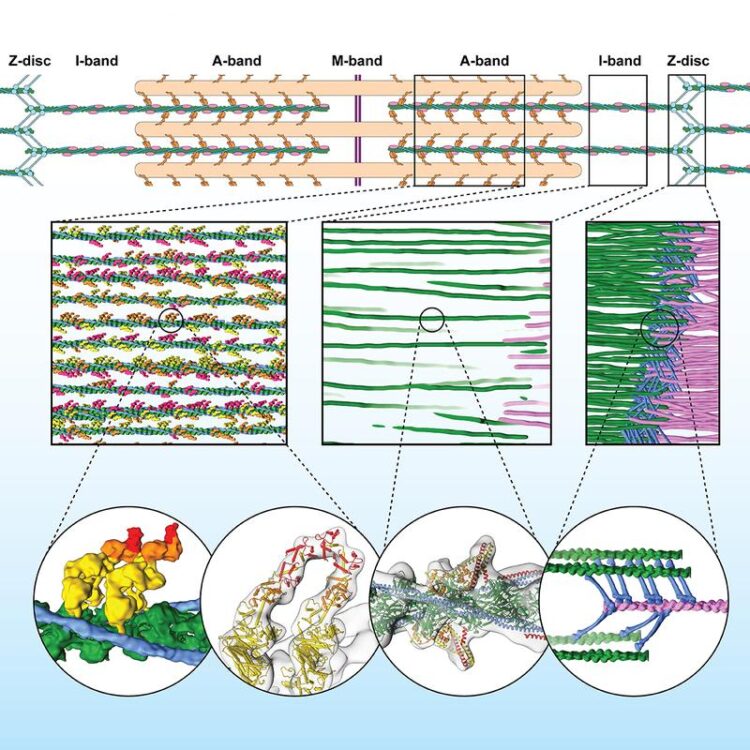
Row 1 shows a schematic representation of the sarcomere. Row 2 shows the three-dimensional sarcomere organization and plasticity at the molecular level (filaments: pink and green, ?-Actinin: blue). Row 3: Interaction of muscle proteins in detail. First two bubbles show the interaction of the myosin heads (yellow, orange, red) with actin (green). Third bubble shows details of actin, tropomyosin and troponin in the A-band. Last bubble depicts irregular mesh of ?-Actinin (blue) cross-linking actin filaments (green, pink) in the Z-disc.
Credit: @MPI of Molecular Physiology
Ein internationales Team unter der Leitung von Stefan Raunser, Direktor am Max-Planck-Institut für molekulare Physiologie in Dortmund, in Zusammenarbeit mit Mathias Gautel vom King’s College in London hat mithilfe der Kryoelektronentomografie das erste hochauflösende 3D-Bild des Sarkomers erstellt, der kontraktilen Grundeinheit von Skelett- und Herzmuskelzellen. Die Fähigkeit der Kryoelektronentomografie, hochaufgelöste Strukturen direkt in gefrorenen Muskelzellen sichtbar zu machen, legt eine wichtige Grundlage für die zukünftige medizinische Behandlungen von Muskelkrankheiten und wird zu einem besseren Verständnis des Alterungsprozesses beitragen.
Sarkomere sind die kleinsten, sich wiederholenden, funktionellen Baueinheiten der Muskelfibrillen. Hunderte dieser parallel angeordneten Fibrillen bilden eine Muskelfaser. Innerhalb der Sarkomere interagieren Filamente der Proteine Myosin und Aktin miteinander und erzeugen dadurch die Kontraktion und Entspannung des Muskels.
Bisherige Untersuchungen zum Aufbau und zur Funktion von Muskeln erreichten keine hohe Auflösung oder wurden nur mit einzelnen Bestandteilen durchgeführt. „Mit der Kryoelektronentomographie können wir die bisherigen Probleme fast vollständig lösen und detaillierte 3D-Bilder des gefrorenen Muskels in einem annährend natürlichen Zustand erhalten“, sagt Prof. Raunser.
Eine alte Technik lässt ihre Muskeln spielen
Obwohl die Kryo-ET eine etablierte Methode zur Darstellung feiner Strukturen in der Zelle ist, ist sie aufgrund ihrer bisherigen Limitierungen nur sehr wenigen Laboren zugänglich. Jüngste technische Fortschritte in der Einzelpartikelkryoelektronenmikroskopie (Kryo-EM) sowie Neuentwicklungen, wie das Fräsen der Probe mit Hilfe eines fokussierten Ionenstrahls in einem Kryorasterelektronenmikroskop, haben sowohl die Auflösungsgrenzen als auch die Nutzbarkeit der Kryo-ET enorm verbessert.
Einblicke in Muskelfibrillen mit nahezu atomarer Auflösung
Bei der Probenvorbereitung im Dortmunder Kryo-Labor wird das von den KollegInnen am King’s College in London isolierte Muskelgewebe zunächst bei ca. -175°C schockgefroren. Dieses Verfahren bewahrt die chemische Feinstruktur der Muskelstrukturen und somit auch ihren natürlichen Zustand. Aus der gefrorenen Probe wird dann mit einem Ionenstrahl ein Teil einer Muskelfibrille herausgefräst. So entsteht eine hauchdünne, elektronendurchlässige Lamelle mit einer Dicke von nur etwa 100 Nanometern. Im Elektronenmikroskop wird nun eine Serie von Bildern erstellt, während die Lamelle schrittweise entlang einer Achse gekippt wird.
Schließlich wird wie bei der Computertomografie in der medizinischen Diagnostik die Serie der zweidimensionalen Bilder zu einem dreidimensionalen Bild verrechnet. Auf diese Weise konnten die Forschenden Einblicke in Maus-Muskelfibrillen im Bereich von 1 Nanometer gewinnen: „Wir können jetzt eine Muskelfibrille mit nahezu atomarer Auflösung betrachten, eine Dimension, die uns bis vor Kurzem noch vollkommen verschlossen war. Das ist faszinierend!“, betont Raunser.
Muskelfasern in ihrer natürlichen Umgebung
Mit der 3D-Rekonstruktion der Muskelfibrillen konnten die Wissenschaftler*innen die dreidimensionale Organisation des gesamten Sarkomers enthüllen. Auch konnten sie die Interaktion von Muskelproteinen in verschiedenen Teilbereichen, wie z.B. der Z-Scheibe, die das Sarkomer auf beiden Seiten abschließt, im Detail beobachten. So bildet die Z-Scheibe ein unregelmäßiges Netz und kann unterschiedliche räumliche Anordnungen annehmen.
Mit einer speziellen Muskelprobe, die stark an Aktin bindendes Myosin enthält, wurde ein Zustand wie im kontrahierten Muskel untersucht. Und tatsächlich konnte so zum ersten Mal sichtbar gemacht werden, wie zwei Köpfchen desselben Myosins an einen Aktinstrang binden. Auch eine weitere, bislang nur vermutete Anordnung dieser Muskelproteine, bei der jeweils ein Myosinköpfchen des Doppelkopfs an zwei verschiedene Aktinstränge bindet, konnte zum ersten Mal experimentell nachgewiesen werden.
„Dies ist erst der Anfang. Kryo-ET entwickelt sich immer mehr von einer Nischen-Technologie zu einer weit verbreiteten Methode innerhalb der Strukturbiologie“, sagt Raunser. „Bald werden wir in der Lage sein, Muskelkrankheiten auf molekularer und sogar atomarer Ebene zu untersuchen.“ Die untersuchten Mäusemuskelzellen sind denen des Menschen sehr ähnlich, dennoch planen die Wissenschaftler*innen, in naher Zukunft auch menschliches Muskelgewebe aus Biopsien oder aus pluripotenten Stammzellen zu untersuchen.
Originalpublikation:
Wang Z, Grange M, Wagner T, Khoo AL, Gautel M, Raunser S
The molecular basis for sarcomere organization in vertebrate skeletal muscle. Cell
https://doi.org/10.1016/j.cell.2021.02.047
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Spitzenforschung in der Bioprozesstechnik
Das IMC Krems University of Applied Sciences (IMC Krems) hat sich im Bereich Bioprocess Engineering (Bioprozess- oder Prozesstechnik) als Institution mit herausragender Expertise im Bereich Fermentationstechnologie etabliert. Unter der Leitung…

Datensammler am Meeresgrund
Neuer Messknoten vor Boknis Eck wurde heute installiert. In der Eckernförder Bucht, knapp zwei Kilometer vor der Küste, befindet sich eine der ältesten marinen Zeitserienstationen weltweit: Boknis Eck. Seit 1957…

Rotorblätter für Mega-Windkraftanlagen optimiert
Ein internationales Forschungsteam an der Fachhochschule (FH) Kiel hat die aerodynamischen Profile von Rotorblättern von Mega-Windkraftanlagen optimiert. Hierfür analysierte das Team den Übergangsbereich von Rotorblättern direkt an der Rotornabe, der…



