Es braucht nicht viele Gene, um komplex zu sein
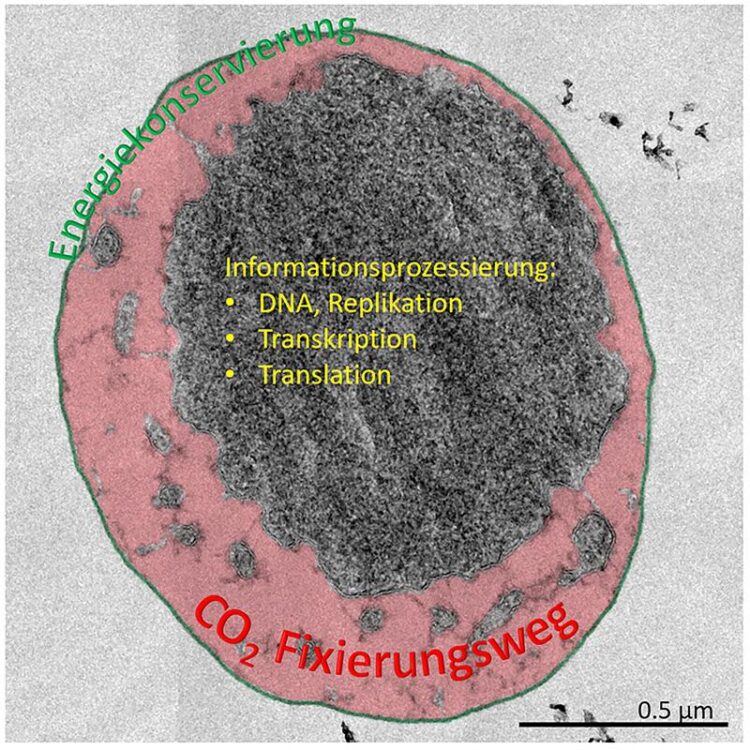
Ignicoccus hospitalis, Ultradünnschnitt. An der äußeren Cytoplasmamembran (grün) findet die Energiekonservierung statt; im peripheren Kompartiment (rot) sind Enzyme des CO2-Fixierungswegs zu finden. Balken, 0.5 µm.
(c) Flechsler, Rachel, Maurer, Hecht
Forscher der Universität Regensburg und der Universität Münster weisen Kompartimente und ihre Funktion in den Zellen von Prokaryonten nach.
Wie komplex sind die Zellen von Prokaryonten wirklich? Für Zellen der Gattung Ignicoccus, Archaeen, die am Archaeenzentrum der Universität Regensburg im Jahr 2000 erstmals beschrieben wurden, war bereits bekannt, dass sie zwei Membranen und somit zwei Kompartimente aufweisen.
Jetzt haben die beiden Forscher Dr. Jennifer Flechsler und Dr. Thomas Heimerl, aus den Teams von Dr. Harald Huber und Professor Dr. Reinhard Rachel (Lehrstuhl für Mikrobiologie / Archaeenzentrum und dem Zentrum für Elektronenmikroskopie der Universität Regensburg) sowie Professor Dr. Ivan Berg (Institut für Molekulare Mikrobiologie und Biotechnologie der Universität Münster) zeigen können, dass in dem äußeren Kompartiment nicht nur die Energieerzeugung und -speicherung, sondern auch die gesamte CO2-Fixierung stattfindet. Ihre Erkenntnisse haben sie in der Fachzeitschrift Proceedings of the National Academy of Sciences of the United States of America veröffentlicht.
Die Ausnahme bestätigt die Regel. Diese nicht gerade neue Erkenntnis gilt auch in der Biologie. Eine solch grundsätzliche Regel dort lautet: die Zellen aller Eukaryonten, also aller höherer Lebewesen wie Pilze, Algen, Pflanzen, Tiere (inclusive des Menschen), sind in mehrere Räume unterteilt. Das sind von Membranen umgebene Strukturen, wie Zellkern, Mitochondrien, ggfs. Chloroplasten bei den Pflanzenzellen, Golgi-Apparat und Endoplasmatisches Retikulum. In der Eukaryonten-Zelle herrscht also „Ordnung“ durch Aufteilung in „Unterräume“, den Kompartimenten. Demgegenüber liegt in den Zellen der Prokaryonten, also Archaeen und Bakterien, alles in einem großen Sack vor, der von einer Membran (Zellmembran) umschlossen ist. Darin befinden sich die DNA, die verschiedenen RNA’s, die Proteinbiosynthese-Maschinen (Ribosomen) und auch alle Enzyme, die für die verschiedenen Leistungen der Zelle benötigt werden. Allerdings kannte man schon einige wenige Vertreter innerhalb der Bakterien wie z.B. die Planctomyceten und die Anammox-Bakterien, bei denen es auch eine Unterteilung der Zellen in bestimmte Kompartimente gibt.
Bei der zweiten prokaryontischen Gruppe, den Archaeen, kennt man nur eine Gattung, mit Namen Ignicoccus (die „Feuerkugel“), die Organismen mit inneren Strukturen aufweist. Diese am Archaeenzentrum der Universität Regensburg im Jahr 2000 erstmals beschriebenen Organismen sind somit deutlich komplizierter als andere Prokaryonten aufgebaut und das, obwohl sie mit eines der kleinsten Genome (nur 1.4 Mio Basen) aller freilebenden Mikroben haben.
Ultradünnschnitte der Zellen deuteten auf einen besonderen Bauplan hin: es gibt in der Zelle zwei Membranen und nicht nur eine. Demzufolge musste es in der Zelle auch zwei Kompartimente geben, was spätere Strukturunter¬suchungen in drei Dimensionen auch bestätigten (Heimerl et al. 2017 Front Microb 8:1072). Damit war auch gezeigt, dass es nicht viele Gene braucht, um eine Zelle mit Kompartimentierung, mit struktureller Komplexität zu bauen.
Jedoch war unklar, was in den unterschiedlichen Kompartimenten der Zelle wirklich ablief. In der Folge konnte gezeigt werden, dass die membrangebundene ATP-Synthase, die für die Erzeugung des ATP – der Energiewährung einer jeden Zelle – verantwortlich war, sich bei Ignicoccus ausschließlich in der äußeren Membran befindet (Küper et al. 2010 PNAS 107:3152). In der gleichen Membran befand sich ein weiterer Komplex mit fundamentaler Bedeutung für den Stoffwechsel in Ignicoccus: die Wasserstoff-Schwefel-Oxidoreductase, die die Energie für die ATP-Bildung in der Zelle bereitstellt. Damit war gezeigt, dass in dem äußeren Kompartiment die Energieerzeugung und -Speicherung erfolgt.
Diese Befunde waren Ausgangspunkt für eine weitere Fragestellung: kann es sein, dass in dem äußeren Kompartiment auch weitere Stoffwechselwege ablaufen? Konkret geht es um die Fixierung von CO2, die diese autotroph wachsenden Zellen durchführen müssen, um neue Zellbausteine, Kohlenhydrate, Aminosäuren und letztendlich DNA, RNA und Proteine aufbauen zu können. Diese Überlegungen stellen aber ein grundsätzliches Problem für eine prokaryontische Zelle dar: üblicherweise werden alle Komponenten in demselben Kompartiment gebildet, in dem sie auch zum Einsatz kommen (da es ja nur eines gibt).
Bei zwei Kompartimenten bedarf es aber mehrerer Transportsysteme, um einen Stoffaustausch zwischen ihnen zu gewährleisten. Kaum vorstellbar? – Nicht bei Ignicoccus! Für diese Zellen konnten jetzt zwei Forscher, Jennifer Flechsler und Thomas Heimerl, in den Teams von Dr. Harald Huber und Prof. Dr. Reinhard Rachel (Universität Regensburg) und Prof. Dr. Ivan Berg (Uni Münster) zeigen, dass in dem äußeren Kompartiment nicht nur die Energieerzeugung und -Speicherung sondern auch die gesamte CO2-Fixierung stattfindet. Dazu wurden die Gene für vier Enzyme dieses vor kurzem entdeckten CO2-Fixierungswegs identifiziert, die Enzyme in vitro synthetisiert und im Bakterium Escherichia coli produziert. Ihre katalytische Aktivität wurde im Labor nachgestellt und ihre subzelluläre Verteilung wurde unmittelbar durch Immunmarkierung an Ultradünnschnitten elektronenmikroskopisch dargestellt.
Die Ergebnisse zeigen: in dem äußeren Kompartiment von Ignicoccus-Zellen finden grundlegend wichtige Stoffwechselwege statt, viel mehr als vermutet, und die Ergebnisse lassen postulieren, dass möglicherweise in dem gleichen Kompartiment noch weitere, sich daran anschließende Reaktionen stattfinden, z.B. erste Schritte in Richtung der Biosynthese von Aminosäuren, den Bausteinen für Proteine. Da die Synthese der Proteine selbst jedoch im Zell-Inneren an den Ribosomen stattfindet, ist zu postulieren, dass über die innere Zellmembran zahlreiche Transportvorgänge stattfinden – für kleine Stoffwechselprodukte, aber auch für ganze Enzyme. Diese Transportvorgänge und ihre Regulation sind noch völlig ungeklärt.
Was ist der Vorteil für Ignicoccus? Das ist noch nicht wirklich verstanden, aber zwei der Ausgangsprodukte für den – autotrophen – Stoffwechsel von Ignicoccus, CO2 und H2, werden bei Ignicoccus gleich im äußersten Bereich der Zelle metabolisiert und in nicht-gasförmige Stoffwechselprodukte umgewandelt. Dabei entstehen Zwischenprodukte, die die DNA schädigen könnten; diese liegt bei Ignicoccus jedoch geschützt im inneren Kompartiment vor. Dazu wird ATP, der energiereiche „Treibstoff“ für den CO2-Fixierungszyklus, in der äußeren Membran hergestellt. Er ist dort in der höchsten Konzentration vorhanden, wo er am meisten gebraucht wird. Das ist unmittelbar von Vorteil.
Ignicoccus dürfte noch für viele weitere Überraschungen gut sein und damit reichlich spannende Fragestellungen für Forscher in der Zukunft bereithalten.
Wissenschaftliche Ansprechpartner:
Prof. Dr. Reinhard Rachel
Universität Regensburg – Zentrum für Elektronenmikroskopie
Tel.: +49 941 943-2837
E-Mail: reinhard.rachel@ur.de
https://www.uni-regensburg.de/biologie-vorklinische-medizin/zentrum-elektronenmi…
Originalpublikation:
Jennifer Flechsler, Thomas Heimerl, Harald Huber, Reinhard Rachel, and Ivan A. Berg.
„Functional compartmentalization and metabolic separation in a prokaryotic cell”;
PNAS – Proceedings of the National Academy of Sciences of the United States of America, 2021
DOI: https://doi.org/10.1073/pnas.2022114118
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Sensoren für „Ladezustand“ biologischer Zellen
Ein Team um den Pflanzenbiotechnologen Prof. Dr. Markus Schwarzländer von der Universität Münster und den Biochemiker Prof. Dr. Bruce Morgan von der Universität des Saarlandes hat Biosensoren entwickelt, mit denen…

Organoide, Innovation und Hoffnung
Transformation der Therapie von Bauchspeicheldrüsenkrebs. Bauchspeicheldrüsenkrebs (Pankreaskarzinom) bleibt eine der schwierigsten Krebsarten, die es zu behandeln gilt, was weltweite Bemühungen zur Erforschung neuer therapeutischer Ansätze anspornt. Eine solche bahnbrechende Initiative…

Leuchtende Zellkerne geben Schlüsselgene preis
Bonner Forscher zeigen, wie Gene, die für Krankheiten relevant sind, leichter identifiziert werden können. Die Identifizierung von Genen, die an der Entstehung von Krankheiten beteiligt sind, ist eine der großen…



