Wie sich Bakterienpopulationen gegen Virusinfektionen schützen
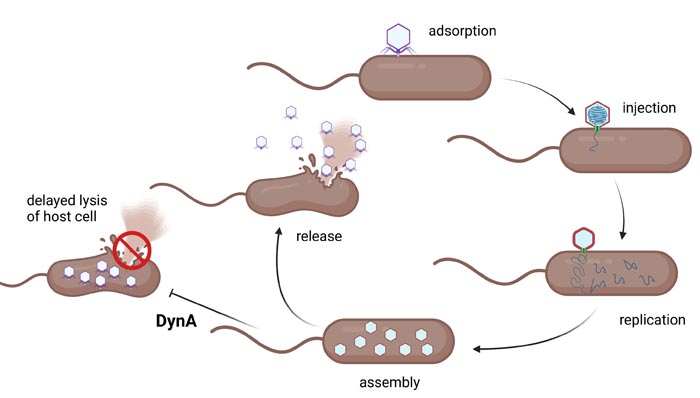
Bakterielle Dynamin-Proteine greifen am Ende des Infektionszyklus ein und helfen, die Lyse der Zellen deutlich zu verlangsamen und so die Freisetzung der Phagennachkommen zu reduzieren.
© Prof. Marc Bramkamp
Letzte Verteidigungslinie:
Ein Forschungsteam aus der CAU-Mikrobiologie beschreibt, wie ein bakterielles Dynamin-Protein an einem bisher unbekannten Schutzmechanismus gegen Bakteriophagen-Infektionen beteiligt ist.
© Dr. Urška Repnik, Zentrale Mikroskopie, Uni Kiel
Bakterien als einzellige Organismen werden von spezialisierten Viren befallen, den sogenannten Bakteriophagen oder kurz Phagen. Zur Abwehr von Phageninfektionen verfügen Bakterien über einen mehrstufigen Schutzmechanismus, der prinzipiell wie bei komplexeren Lebewesen aus Komponenten eines angeborenen und eines erworbenen Immunsystem besteht. Er kann den Ablauf einer Infektion an verschiedenen Stellen unterbrechen, indem zum Beispiel das Andocken eines Phagen an die Zelloberfläche und das Eindringen von Phagen-DNA in die Zelle verhindert, fremde Erbinformationen gezielt entfernt oder die Vervielfältigung der Phagen in der Zelle unterbunden werden.
Einem Forschungsteam von der Christian-Albrechts-Universität zu Kiel (CAU) gelang es nun, einen zusätzlichen Schutzmechanismus in dieser Kaskade der bakteriellen Abwehr zu identifizieren. Die Wissenschaftlerinnen und Wissenschaftler aus der Arbeitsgruppe Mikrobielle Biochemie und Zellbiologie um Professor Marc Bramkamp untersuchten dazu Proteine aus der sogenannten Dynamin-Familie, deren Beteiligung an verschiedenen Prozessen in den Zellmembranen vielzelliger Lebewesen bereits bekannt war.
Die Kieler Forschenden fanden heraus, dass Dynamin bei Bakterien auch eine wichtige Rolle in der Abwehr von Infektionen spielt: Die Proteine hindern durch die Aufrechterhaltung einer intakten Zellmembran Bakterienzellen daran, zu platzen und so die darin enthaltenen Phagen explosiv zu verteilen. Damit fügen sie dem Infektionsschutz der Bakterien eine weitere Barriere hinzu, die trotz bereits infizierter Zellen die Verbreitung von Viren in der Bakterienpopulation hemmen kann. Ihre neuen Forschungsergebnisse veröffentlichten die Kieler Forschenden gemeinsam mit Kolleginnen und Kollegen von der Universität Marburg heute in der Fachzeitschrift mBio.
Dynamin hält Zellmembranen zusammen
Dynamin-Proteine sind bei vielzelligen Lebewesen an zahlreichen zellulären Prozessen beteiligt, die auf Eingriffen in die Zellmembran beruhen. Dazu gehört zum Beispiel die Abschnürung kleiner Membranbestandteile, der Vesikel, die bei vielzelligen Lebewesen Botenstoffe zwischen Zellen des Nervensystems transportieren. Bramkamps Arbeitsgruppe konnte bereits vor einigen Jahren belegen, dass Dynamine auch bei einzelligen Lebewesen wie Bakterien vorkommen und dort durch die Bildung sogenannter Oligomere Membranbestandteile festhalten und zusammenfügen können. „Wozu diese Fähigkeit in Bakterien dient, war bislang noch nicht bekannt. In vielzelligen Lebewesen sind ähnliche Proteine allerdings an der Bekämpfung von Virusinfektionen beteiligt, so dass wir auch bei Bakterien eine Rolle in der Immunabwehr vermuteten“, erklärt Bramkamp.
Treffen Bakteriophagen auf eine Bakterienpopulation, hängt es von der Art der Phagen ab, wie die Infektion abläuft. Einige Erreger dringen zwar in die Bakterien ein und bauen dort ihr Erbgut in das Chromosom des Wirtes ein. Zur Vermehrung der Phagen und damit den schädlichen Folgen für die Bakterienzellen kommt es aber nur dann, wenn es dem Wirtslebewesen schlecht geht. Dieser Modus tritt auch bei zahlreichen Viren auf, die Menschen befallen und nur bei einem geschwächten Immunsystem Krankheitssymptome auslösen. Andere Erreger, die sogenannten lytischen Bakteriophagen, verursachen hingegen einen Infektionszyklus, der auf die direkte Vermehrung und Verbreitung angelegt ist. Gelingt es der Bakterienzelle nicht, diesen Verlauf zu unterbrechen, endet die Infektion mit ihrer Zerstörung: Ein Phagenprotein perforiert die Zellmembran, was zum Aufplatzen und der anschließenden Streuung der Phagen führt, die dann zahlreiche weitere Infektionen verursachen.
Letzter Schutzwall gegen Phageninfektionen
Um die Frage zu klären, ob Dynamin auch bei Bakterien mit der Virenabwehr zusammenhängt, haben die Kieler Forschenden Experimente mit dem bakteriellen Modellorganismus Bacillus subtilis durchgeführt. Sie haben untersucht, ob die An- oder Abwesenheit von Dynamin in den Bakterienzellen einen Effekt auf den Verlauf einer Phageninfektion hat. Dazu schufen sie experimentell verschiedene Bakterienkulturen, in denen das Dynamin entweder abwesend oder verstärkt vorhanden war. „Es zeigte sich, dass die Kulturen sehr sensitiv gegenüber Phageninfektionen werden, wenn das Dynamin fehlt und sie viel schneller und effektiver infiziert werden. Die Gegenprobe bestätigte dann, dass bei Zellen mit hochreguliertem Dynamin eine fast vollständige Resistenz gegenüber Phageninfektionen zu beobachten war“, unterstreicht Bramkamp.
Um den funktionellen Zusammenhang zu erklären, haben die Forschenden den Infektionsmechanismus und die Rolle des Dynamins Schritt für Schritt beobachtet. „Der Zyklus läuft zunächst von der Anheftung des Phagen bis zu seiner Vervielfältigung im Innern der Zelle normal ab. Tatsächlich tritt das Dynamin dann aber ganz Schluss im Zusammenhang mit einem zusätzlichen Resistenzmechanismus in Erscheinung. Es sorgt dafür, dass die infizierten Zellen verzögert lysieren, also langsamer zerstört werden und vor allem nicht explosionsartig aufplatzen“, so Bramkamp. Diesen Effekt konnten die Forschenden anhand von Bildgebungsverfahren bestätigen: Fluoreszenz-markierte Zellen zeigten, dass die Zellintegrität in Anwesenheit von Dynamin länger gewahrt bleibt. „Darüber hinaus konnten wir beobachten, wie sich Dynamin-Proteine an der Zellmembran sammeln. Das Protein ist nach der Infektion nicht mehr gleichmäßig und dynamisch in der Bakterienzelle verteilt. Stattdessen sammelt es sich an der Stelle, an der die Zellmembran angegriffen wird, und verzögert deren Zerreißen erheblich“, erklärt Co-Autor Peter Graumann, Professor für Biochemie an der Universität Marburg.
Obwohl die Anwesenheit von Dynamin nicht verhindern kann, dass infizierte Bakterienzellen zerstört werden, wirkt der Mechanismus einer Infektion trotzdem effektiv entgegen: Durch die Vermeidung der explosiven Ausbreitung werden die Phagen weniger gut in der Population verteilt und die Infektion breitet sich langsamer aus, gleichzeitig können die übrigen Ebenen der bakteriellen Phagenabwehr in der Gesamtpopulation erneut greifen. Der Schutzeffekt des Dynamins ist dabei nicht spezifisch und umfasst lytische und nicht-lytische Phagenarten gleichermaßen. „So entsteht eine letzte Verteidigungslinie, die die früher im Infektionszyklus ansetzenden Resistenzmechanismen vervollständigt. Auf Populationsebene werden die Bakterien also insgesamt deutlich unempfindlicher gegenüber Phageninfektionen, was ihnen einen wichtigen evolutiven Vorteil verschafft“, fasst Bramkamp zusammen.
Fotos stehen zum Download bereit:
https://www.uni-kiel.de/de/pressemitteilungen/2022/021-bramkamp-mbio-phage.jpg
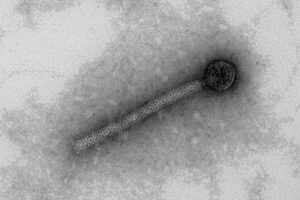
Bildunterschrift: Transmissionselektronenmikroskopische Aufnahme eines Bakteriophagen: Diese bakterienspezifischen Viren vervielfältigen zunächst ihr Ergbut in infizieren Bakterienzellen, um anschließend ihre Nachkommen aus spezifischen Proteinen darin zusammenzubauen und diese nach der Zerstörung der Wirtszellen freizusetzen.
© Dr. Urška Repnik, Zentrale Mikroskopie, Uni Kiel
https://www.uni-kiel.de/de/pressemitteilungen/2022/021-bramkamp-mbio-cycle.jpg
Bildunterschrift: Bakterielle Dynamin-Proteine greifen am Ende des Infektionszyklus ein und helfen, die Lyse der Zellen deutlich zu verlangsamen und so die Freisetzung der Phagennachkommen zu reduzieren.
© Prof. Marc Bramkamp
Weitere Informationen:
Arbeitsgruppe Mikrobielle Biochemie und Zellbiologie,
Institut für Allgemeine Mikrobiologie, CAU:
https://www.bramkamplab.org
Wissenschaftliche Ansprechpartner:
Prof. Marc Bramkamp
Arbeitsgruppe Mikrobielle Biochemie und Zellbiologie,
Institut für Allgemeine Mikrobiologie, CAU
Tel.: 0431-880-4341
E-Mail: bramkamp@ifam.uni-kiel.de
Originalpublikation:
Lijun Guo, Laura Sattler, Samia Shafqat, Peter L. Graumann and Marc Bramkamp (2022): A bacterial dynamin-like protein confers a novel phage resistance strategy on the population level in Bacillus subtilis. mBio First published: 15. February 2022
https://doi.org/10.1128/mbio.03753-21
Weitere Informationen:
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Spitzenforschung in der Bioprozesstechnik
Das IMC Krems University of Applied Sciences (IMC Krems) hat sich im Bereich Bioprocess Engineering (Bioprozess- oder Prozesstechnik) als Institution mit herausragender Expertise im Bereich Fermentationstechnologie etabliert. Unter der Leitung…

Datensammler am Meeresgrund
Neuer Messknoten vor Boknis Eck wurde heute installiert. In der Eckernförder Bucht, knapp zwei Kilometer vor der Küste, befindet sich eine der ältesten marinen Zeitserienstationen weltweit: Boknis Eck. Seit 1957…

Rotorblätter für Mega-Windkraftanlagen optimiert
Ein internationales Forschungsteam an der Fachhochschule (FH) Kiel hat die aerodynamischen Profile von Rotorblättern von Mega-Windkraftanlagen optimiert. Hierfür analysierte das Team den Übergangsbereich von Rotorblättern direkt an der Rotornabe, der…



