Neue Nanowelt in Zellen entdeckt
Winzige Nanodomänen für Signale in einer Zelle
Bild: Charlotte Kayser, MDC Berlin
Wie eine Zelle Hunderte Signale gleichzeitig verarbeiten kann, zeigt ein Forschungsteam um Martin Lohse jetzt im Fachblatt „Cell“. Die neuen Ergebnisse werden ein komplett neues Forschungsfeld in der Zellbiologie eröffnen.
Eine lebende Zelle ist vielfältigen Reizen ausgesetzt. Unzählige Botenstoffe docken an ihrer Oberfläche an, übermitteln ihre Botschaften und lösen Signale im Zellinneren aus. Daraufhin ändert die Zelle ihre Funktionen, ihren Stoffwechsel oder schaltet Gene im Zellkern ein- oder aus. Rezeptoren in der Zellmembran nehmen die Informationen für all diese Aufträge an. Aufgenommen werden die Botschaften der Außenwelt von vielen unterschiedlichen Rezeptoren, die in der Zellmembran sitzen.
Wie aber schafft es die Zelle, zwischen den Signalen verschiedener Rezeptoren zu unterscheiden? Dass bislang unbekannte Nanodomänen eine entscheidende Rolle spielen, wies nun ein Team um den Pharmakologen Martin Lohse mit Forschern aus dem Max-Delbrück-Centrum in Berlin, der Universität Würzburg und ISAR Bioscience nach.
Mehr als 800 unterschiedliche Rezeptoren gibt es, die auf der Zelloberfläche sitzen. Auf einer einzelnen Zelle können bis zu hundert verschiedene Rezeptor-Typen sitzen und diese sprechen wiederum auf ganz unterschiedliche Botenstoffe an. „Von außen kommen zahllose Signale, die ganz spezifisch von Rezeptoren erkannt werden – aber in der Zelle gibt es nur eine Handvoll Moleküle, die auf die Aktivierung reagieren. Dennoch erledigen sie vielfältige und völlig unterschiedliche Aufgaben“, sagt Andreas Bock. Der langjährige Mitarbeiter von Martin Lohse ist seit Anfang 2022 Professor an der Universität Leipzig und Letztautor der kürzlich veröffentlichten Studie in der renommierten Fachzeitschrift „Cell“.
Kommunikation in nanometergroßen Räumen
Cyclisches Adenosinmonophosphat (cAMP) ist das wichtigste Signalmolekül in der Zelle. Es wird hergestellt, wenn bestimmte Rezeptoren stimuliert werden. Ein Beispiel: Regt man Herzmuskelzellen mit Adrenalin an, dann erhöht sich ihr cAMP-Spiegel und das Herz kontrahiert schneller und kräftiger. Werden die gleichen Zellen mit Prostaglandin stimuliert, entsteht zwar die gleiche Menge cAMP, doch der Herzmuskel reagiert erstaunlicherweise kaum.
Mit Fluoreszenzmikroskopie untersuchten die Forschenden an isolierten Einzelzellen, wie die cAMP-Signale von zwei verschiedenen Rezeptoren parallel in einer Zelle entstehen und verarbeitet werden. Sie erkannten, dass sich unter Normalbedingungen die Erhöhung des cAMP-Spiegels auf winzig kleine Domänen direkt am aktivierten Rezeptor mit einem Radius zwischen 30 und 60 Nanometern beschränkt. „Das sind abgeschottete Räume, in denen die cAMP-Konzentration sehr hoch ist – in ihnen entstehen die unterschiedlichen Wirkungen des cAMP“, erläutert Andreas Bock „Wir vermuten, dass über die enge Lokalisation der Nanoräume die hohe Spezifität von Rezeptor-Stimuli entsteht. Wir haben diese kleinen Räume RAINs genannt: Rezeptor-assoziierte unabhängige Nanodomänen.“
„Die Entdeckung der Nanodomänen erhöht die Komplexität von Signalwegen in der Zelle um ein Vielfaches gegenüber unseren bisherigen Vorstellungen“, sagt Dr. Charlotte Kayser. Gemeinsam mit Dr. Selma Anton ist sie Erstautorin der Studie. Signale, die am Rezeptor entstehen, bleiben erst einmal vor Ort und beeinflussen nur die Enzyme in unmittelbarer Umgebung. Andere Bereiche in der Zelle werden durch die Signale also nicht angesprochen. Dadurch können einzelne Signalwege sehr lokal ein- und ausgeschaltet werden.
Lange betrachtete die Wissenschaft das Cytosol, das Innere der Zelle, als ein großes „Schwimmbecken“, in dem sich Zellbestandteile frei tummeln. Doch es scheint bislang unbekannte Strukturen zu geben, die das Zellinnere um jeden einzelnen Rezeptor herum gliedern. „Wir können die Nanoräume nicht direkt sehen – selbst für die besten Lichtmikroskope sind sie zu klein“, erläutert Seniorautor Professor Martin Lohse, früherer Leiter des Max-Delbrück-Centrums und jetzt Chairman von ISAR Bioscience.
Zellen können große Mengen an Signalen parallel verarbeiten
Die Zelle scheint demnach kein Schalter zu sein, der entweder „An“ oder „Aus“ ist. Sie funktioniere eher wie ein Chip, bei dem auf kleinster Fläche viele Signale gleichzeitig verarbeitet werden, sagt Lohse. „Das ist zum Beispiel sehr wichtig für Nervenzellen, die auf diese Weise an ihren Ausläufern jeweils unterschiedliche Signale verarbeiten können: Eine Stelle kann aktiviert sein, während eine weitere ruht und eine dritte gehemmt wird.“
Sobald die Wissenschaftler eine Zelle mit geringen Mengen von Botenstoff – Hormon oder Neurotransmitter – stimulierten, waren die Nanodomänen stark ausgeprägt. Bei stärkerer Stimulation kam es zum „Überlaufen“ der Signalmoleküle und die Räume begannen zu verschmelzen. Das könnte sich medizinisch nutzen lassen. „Womöglich kann man mit Substanzen, die in unterschiedlichem Maße Rezeptoren stimulieren – ich denke zum Beispiel an Opioide – nicht nur quantitativ, sondern auch qualitativ unterschiedliche Effekte erzeugen. Je nachdem, ob die ausgelösten cAMP-Signale nur einzelne Regionen der Zelle betreffen oder die ganze Zelle erfassen“, ergänzt Martin Lohse.
„Wir haben einen ersten Blick auf eine bisher ungeahnte Nanowelt innerhalb von Zellen getan“, sagt Lohse. „Mit Forschungsmitteln des European Research Council haben wir seit 2008 nach einer „Quantenwelt“ für zelluläre Signale gesucht – jetzt können wir sagen, dass es sie wirklich gibt.“ Zunächst gilt es, den Aufbau und die Bestandteile solcher Nanodomänen besser zu verstehen. Erste Befunde zeigen aber bereits, dass sie bei kranken Zellen, wie Leberkrebszellen oder im kranken Herzen, nicht mehr richtig funktionieren. Damit werden die zelluläre Nanowelt auch für die Medizin interessant.
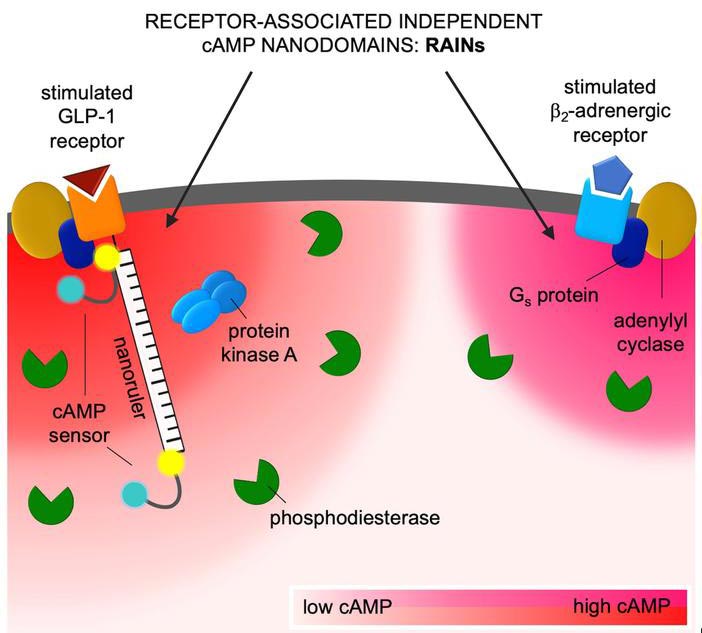
Winzige Nanodomänen für Signale in einer Zelle.
Das Bild zeigt einen Ausschnitt einer Zelle, oben befinden sich beispielhaft zwei verschiedene Rezeptoren an der Zelloberfläche: Links ein Rezeptor für GLP-1, ein Hormon, dessen Funktion bei der Zuckerkrankheit gestört ist, rechts ein Rezeptor für das Stresshormon Adrenalin. Beide Rezeptoren lösen über verschiedene Zwischenschritte die Produktion des Signalmoleküls cAMP in der Zelle aus – aber jeder Rezeptor tut das in einer winzig kleinen eigenen Nanodomäne. Auf diese Weise kann eine Zelle die Signale vieler verschiedener Rezeptoren gleichzeitig unabhängig verarbeiten. (Bild: Charlotte Kayser, MDC Berlin)
Wissenschaftliche Ansprechpartner:
Prof. Dr. Martin Lohse, ISAR Bioscience
Prof. Dr. Andreas Bock, Universität Leipzig
Originalpublikation:
Anton SE, Kayser C, Maiellaro I, Nemec K, Möller J, Koschinski A, Zaccolo M, Annibale P, Falcke M, Lohse MJ, Bock A (2022) Receptor-associated independent cAMP nanodomains mediate spatiotemporal specificity of GPCR signaling.
Cell DOI: https://doi.org/10.1016/j.cell.2022.02.011.
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Spitzenforschung in der Bioprozesstechnik
Das IMC Krems University of Applied Sciences (IMC Krems) hat sich im Bereich Bioprocess Engineering (Bioprozess- oder Prozesstechnik) als Institution mit herausragender Expertise im Bereich Fermentationstechnologie etabliert. Unter der Leitung…

Datensammler am Meeresgrund
Neuer Messknoten vor Boknis Eck wurde heute installiert. In der Eckernförder Bucht, knapp zwei Kilometer vor der Küste, befindet sich eine der ältesten marinen Zeitserienstationen weltweit: Boknis Eck. Seit 1957…

Rotorblätter für Mega-Windkraftanlagen optimiert
Ein internationales Forschungsteam an der Fachhochschule (FH) Kiel hat die aerodynamischen Profile von Rotorblättern von Mega-Windkraftanlagen optimiert. Hierfür analysierte das Team den Übergangsbereich von Rotorblättern direkt an der Rotornabe, der…



