Warum Nervenzellen schneller arbeiten als die Theorie erlaubt
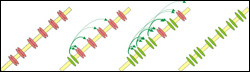
Modellvorstellung der kooperativen Arbeitsweise von Natriumkanälen und dem damit verbundenen sprunghaften Anstieg eines Aktionspotentials in Nervenzellen von Säugetieren. Durch ihr kooperatives Öffnen setzt ein starker Natriumeinstrom in die Zelle bereits in den ersten 200 Mikrosekunden ein. Bild: Max-Planck-Institut für Dynamik und Selbstorganisation
Bekanntlich kommunizieren Nervenzellen untereinander, indem sie kurze elektrische Impulse aussenden und empfangen. Seit einiger Zeit ist klar geworden, dass die meisten dieser Signale im lebenden Gehirn unbeantwortet bleiben. In jeder Sekunde empfängt eine typische Zelle der Großhirnrinde Tausende Signale von anderen Nervenzellen. Sie entschließt sich aber in der gleichen Zeit nur selten – oft nicht mehr als ein Dutzend mal – selbst einen Impuls auszusenden. Mit bisher nicht gekannter Genauigkeit haben jetzt Max-Planck-Forscher des Max-Planck-Instituts für Dynamik und Selbstorganisation und des Bernstein Center for Computational Neuroscience in Göttingen zusammen mit dem Neurophysiologen Maxim Volgushev der Ruhr-Universität Bochum analysiert, nach welchen Regeln Nervenzellen in der Großhirnrinde sich dazu entschließen, Nervenimpulse auszusenden.
Erstaunlicherweise fanden sie, dass die hohe Flexibilität und Geschwindigkeit, mit der diese Zellen arbeiten, nicht mit dem bisherigen zentralen Modell der Neurophysiologie, dem Hodgkin-Huxley-Modell, zu erklären ist. Nach ihren Erkenntnissen arbeiten die Natriumkanäle, die sich während eines Nervenimpulses in der Zellmembran öffnen, nicht wie bislang angenommen, unabhängig voneinander, sondern scheinen sich beim Öffnungsvorgang gegenseitig zu unterstützen. Dieser neuartige Mechanismus kann den Zellen dabei zu helfen, schnellveränderliche Signale weiterzuleiten und langsame Signale zu unterdrücken. (Nature, Volume 440, Number 7087, 2006)
Jede lebende Zelle hält über ihrer Zellmembran eine elektrische Spannungsdifferenz aufrecht. Nervenzellen zeichnen sich vor anderen Zellen dadurch aus, dass sie diese Spannungsdifferenz zum Verarbeiten und Weiterleiten von Nachrichten nutzen. Erhält eine Nervenzelle einen starken Reiz, dann kommt es zu einer Umkehrung der elektrischen Spannung über der Zellmembran. Dieses „Aktionspotential“ breitet sich an den langen Fortsätzen der Zelle mit hoher Geschwindigkeit aus, an deren Ende das Signal an andere Nervenzellen übertragen wird. Wie ein solches Aktionspotential entsteht, wurde im Jahre 1952 von Alan Lloyd Hodgkin und Andrew Fielding Huxley anhand von Messungen an Neuronen des Tintenfisches in einem mathematischen Modell beschrieben. Das Hodgkin-Huxley-Modell, für das die Wissenschaftler später mit dem Nobelpreis ausgezeichnet wurden, dient seitdem zur Erklärung von Signalprozessen in allen Neuronen.
Nach dem Hodgkin-Huxley-Modell wird ein Aktionspotential ausgelöst, wenn sich die elektrische Spannung über der Membran der Nervenzelle bis zu einem gewissen Schwellenwert verändert. Bestimmte Natriumkanäle reagieren auf diese Spannungsveränderung, öffnen sich und lösen dadurch eine lawinenartige Reaktion aus. Durch die geöffneten Kanäle strömen positiv geladene Natriumionen in die Zelle, was zur weiteren Verschiebung des Membranpotentials und der Öffnung weiterer Natriumkanäle führt. Der Schwellenwert und auch die Schnelligkeit, mit der ein Aktionspotential entsteht, variieren dabei von Zelle zu Zelle – für eine einzelne Zelle sind diese Parameter aber durch die Eigenschaften ihrer Natriumkanäle weitgehend festgelegt.
Ein interdisziplinäres Team von Physikern und Neurophysiologen vom Göttinger Max-Planck-Institut für Dynamik und Selbstorganisation und der Ruhr-Universität Bochum hat nun die Schnelligkeit und den Schwellenwert von Aktionspotentialen in Nervenzellen der Großhirnrinde des Säugergehirns genauer untersucht. Sie konnten zeigen, dass hier Aktionspotentiale sehr sprunghaft einsetzen. Obwohl ein einzelnes Aktionspotential gut eine Millisekunde andauert, setzt ein starker Natriumeinstrom bereits in den ersten 200 Mikrosekunden ein. Die Natriumkanäle scheinen sich demnach fast gleichzeitig zu öffnen, so dass Natriumionen sehr schnell und in großen Mengen in die Zelle strömen können. Gleichzeitig aber fanden die Forscher in ihren Messungen, dass die Schwellenwerte, bei denen die Aktionspotentiale einsetzten, sehr variabel sind.
Um zu verstehen wodurch dieses ungewöhnliche Verhalten zustande kommt versuchten die Wissenschaftler zunächst das Verhalten der Zellen in Computersimulationen des Hodgkin-Huxley-Modells nachzubilden. Dabei stellte sich zu ihrer Überraschung heraus, dass eine hohe Variabilität beim Schwellenwert und ein sprunghafter Anstieg des Aktionspotentials im Rahmen dieses Modells nicht zu vereinen sind. Die beiden Eigenschaften verhalten sich in dem Modell wie die beiden Seiten einer Wippe. Setzt man eine hohe Variabilität beim Schwellenwert an, so verlangt das Modell eine niedrige Schnelligkeit beim Einsetzen des Aktionspotentials. Fordert man eine hohe Schnelligkeit, ist die Variabilität des Schwellenwerts gering.
Um das beobachtete Verhalten der Nervenzellen dennoch in Computersimulationen nachbilden zu können, postulierten Wolf und seine Kollegen einen neuen Mechanismus, der erklärt, wie sich Natriumkanäle zwar nicht immer bei dem gleichen Schwellenwert, aber dennoch fast synchron öffnen. Öffnet sich ein Natriumkanal, so beeinflusst das nach dem neuen Modell andere Natriumkanäle in der direkten Nachbarschaft – die Kanäle öffnen „kooperativ“ und nicht – wie nach Hodgkin-Huxley – unabhängig voneinander und ausschließlich in Abhängigkeit von der Spannung über der Membran. Um diese Hypothese zu testen, nutzten die Wissenschaftler einen Trick: Wenn es gelänge, den kooperativen Mechanismus messbar zu unterbinden, so wäre das ein gutes Argument für seine Existenz. Das erreichten sie, indem sie mit dem Nervengift Tetrodoxin einen Teil der Natriumkanäle blockierten, so dass die noch funktionsfähigen Kanäle so weit in der Membran verstreut lagen, dass sie nicht mehr kooperieren konnten. Die in solchen Experimenten beobachteten Aktionspotentiale wiesen wie erwartet eine weit langsamere Dynamik auf.
In weiteren Untersuchungen konnten die Forscher zeigen, dass die Zellen diesen neuartigen Mechanismus wahrscheinlich verwenden, um zwischen den empfangenen Signalen zu differenzieren und nur auf bestimmte zu antworten. „Die Zellen funktionieren wie ein Hochpassfilter“, so fasst Bjoern Naundorf die Ergebnisse dieser Untersuchungen zusammen, „schnelle Signale werden gut weitergeleitet, langsame Signale werden unterdrückt.“ Die beiden Aspekte der Aktionspotentialauslösung spielen dabei unterschiedliche Rollen. Die große Variabilität der Schwellenpotentiale ermöglicht es den Zellen, langsam einsetzende Reize zu ignorieren. Sie erhöhen dann fortlaufend ihre Schwelle, so dass in vielen Fällen gar kein Impuls ausgelöst wird. Die schnelle Auslösung der Aktionspotentiale dagegen hilft den Zellen schnell veränderliche Signale auch mit hoher Präzision weiterzugeben. Nach dem Hodgkin-Huxley-Modell wären sie hierzu aber gar nicht in der Lage.
„Viele Wissenschaftler – uns eingeschlossen – sahen das Hodgkin-Huxley-Modell bislang gar nicht mehr als Hypothese an, sondern glaubten, dass es im Prinzip auf alle Neurone anwendbar ist“, sagt Fred Wolf, der die Untersuchungen am Göttinger Max-Planck-Institut für Dynamik und Selbstorganisation leitete. Dass dem nicht so ist, haben er und seine Kollegen nun gezeigt. Die bessere Hirnleistung von höheren Tieren, wie Katzen oder auch Menschen, gegenüber Tintenfischen oder auch Schnecken, ist nach ihren Ergebnissen nicht nur auf die höhere Zahl der Neurone in den Gehirnen dieser Tiere zurückzuführen, sondern eben auch auf die Art und Weise, wie die Neurone Signale verarbeiten. Vermutlich nutzen sie dafür molekulare Mechanismen, die niederen Tieren nicht zur Verfügung stehen.
Originalveröffentlichung:
Naundorf, B., Wolf, F and Volgushev, M.
Unique features of action potential initiation in cortical neurons
Nature, Volume 440, Number 7087, 2006
Media Contact
Weitere Informationen:
http://www.mpg.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Sensoren für „Ladezustand“ biologischer Zellen
Ein Team um den Pflanzenbiotechnologen Prof. Dr. Markus Schwarzländer von der Universität Münster und den Biochemiker Prof. Dr. Bruce Morgan von der Universität des Saarlandes hat Biosensoren entwickelt, mit denen…

Organoide, Innovation und Hoffnung
Transformation der Therapie von Bauchspeicheldrüsenkrebs. Bauchspeicheldrüsenkrebs (Pankreaskarzinom) bleibt eine der schwierigsten Krebsarten, die es zu behandeln gilt, was weltweite Bemühungen zur Erforschung neuer therapeutischer Ansätze anspornt. Eine solche bahnbrechende Initiative…

Leuchtende Zellkerne geben Schlüsselgene preis
Bonner Forscher zeigen, wie Gene, die für Krankheiten relevant sind, leichter identifiziert werden können. Die Identifizierung von Genen, die an der Entstehung von Krankheiten beteiligt sind, ist eine der großen…



