Bauchspeicheldrüsenkrebs: Der molekulare Fingerabdruck des Tumors entscheidet über die Wirksamkeit der Tumortherapie
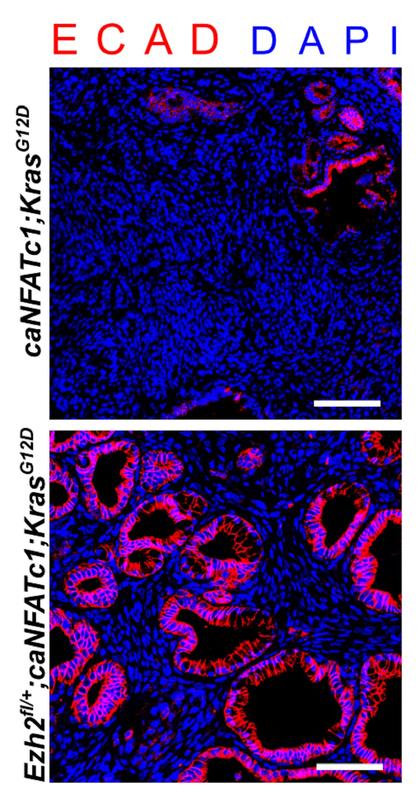
Tumoren der Bauchspeicheldrüse von Mäusen mit verschiedenen genetischen Merkmalen unterscheiden sich in der Struktur und ihren molekularen Charakteristika (rote Immunfluoreszenzfärbung).
© Elisabeth Heßmann, UMG
Bauchspeicheldrüsenkrebs zählt zu den größten Herausforderungen der modernen Krebsmedizin. Trotz intensiver Forschungsbemühungen versterben die meisten Patienten mit fortgeschrittenem Pankreaskarzinom innerhalb eines Jahres nach Diagnosestellung. Neue Behandlungsstrategien und individualisierte Therapiekonzepte werden daher dringend benötigt, um die Prognose zu verbessern. Diese Zielsetzung verfolgte auch ein Forscherteam an der Universitätsmedizin Göttingen in einem von der Wilhelm Sander-Stiftung geförderten Forschungsprojekt. Die Forscher fanden heraus, dass eine bestimmte molekulare Veränderung in den Krebszellen wesentlichen Einfluss auf deren Ansprechen auf eine neuartige Therapie hat.
Die Prognose bei Bauchspeicheldrüsenkrebs (Pankreaskarzinom) ist mit einer Fünf-Jahres-Überlebensrate von unter acht Prozent weiterhin sehr schlecht. Aktuellen Erhebungen zufolge wird das Pankreaskarzinom schon in wenigen Jahren die zweithäufigste krebsbedingte Todesursache in westlichen Ländern darstellen.
Gründe für die schlechte Prognose der Erkrankung sind, dass der Tumor früh ins umliegende Gewebe einwächst, schnell in andere Organe streut und schlecht auf herkömmlichen Therapien anspricht. Jüngste Erkenntnisse vielfältiger Forschungsanstrengungen von Experten auf dem Gebiet der Bauchspeicheldrüsenkrebsforschung legen nahe, dass bestimmte molekulare Veränderungen in der Tumorzelle nicht nur das aggressive Wachstumsverhalten des Tumors begünstigen, sondern auch das Ansprechen auf eine Tumortherapie beeinflussen.
Während Tumoren mit einer molekularen Veränderung „A“ besonders gut auf eine bestimmte Chemotherapie ansprechen, profitieren Patienten, deren Bauchspeicheldrüsenkrebs dieses Merkmal nicht aufweist, nicht von derselben Therapie. In der modernen Krebsmedizin gilt es also, auch bei der Behandlung des Pankreaskarzinoms den „molekularen Fingerabdruck“ des Tumors für eine individuelle Therapie zu berücksichtigen, um die Prognose der Erkrankung zu verbessern und den Patienten Nebenwirkungen nichtwirksamer Tumortherapien zu ersparen.
Epigenetische Regulatoren als neue Zielstrukturen der Tumortherapie
Der Einfluss des molekularen Fingerabdrucks auf das Therapieansprechen von Tumoren ist besonders bedeutsam für moderne Behandlungsverfahren, deren Zielstrukturen sogenannte „epigenetische Regulatoren“ sind. Epigenetische Regulatoren koordinieren die Chromatinstruktur aller Körperzellen, das heißt die „Verpackung“ und Zugänglichkeit der genetischen Information. Liegen Fehlregulationen epigenetischer Eiweiße vor, kann dies die Entstehung und das Wachstum von Tumoren fördern.
Da die Regulation der genomweiten Chromatinstruktur aber ein sehr dynamischer Prozess ist und rückgängig gemacht werden kann, rückt die Hemmung fehlgesteuerter epigenetischer Regulatoren (epigenetische Therapie) immer weiter in den Fokus der Tumortherapie, auch bei der Behandlung des Bauchspeicheldrüsenkrebses. Trotz erster vielversprechender Daten sind Hemmstoffe epigenetischer Regulatoren aber noch kein fester Bestandteil in der Therapie des Bauchspeicheldrüsenkrebses. Noch zu wenig ist über das komplexe Zusammenspiel molekularer Tumorcharakteristika und der Funktion epigenetischer Regulatoren bekannt (Hessmann E et al., Physiol Rev. 2020).
Der molekulare Fingerabdruck des Tumors bestimmt die Wirksamkeit epigenetischer Therapien
Wie sich der molekulare Fingerabdruck der Pankreaskarzinomzelle auf das Ansprechen des Tumors auf eine epigenetische Therapie auswirkt, hat nun ein Team von Wissenschaftlern unter der Leitung von PD Dr. Elisabeth Heßmann von der Klinik für Gastroenterologie, gastrointestinale Onkologie und Endokrinologie der Universitätsmedizin Göttingen erforscht. Im Rahmen des von der Wilhelm Sander-Stiftung geförderten Projektes untersuchte das Forscherteam zum einen die Funktion epigenetischer Regulatoren und zum anderen das Potential ihrer gezielten Hemmung im Bauchspeicheldrüsenkrebs.
Erste Ergebnisse zur Rolle des epigenetischen Regulators EZH2 im Bauchspeicheldrüsenkrebs konnten kürzlich in der Fachzeitschrift Cancer Research (Patil S et al., Cancer Res. 2020) publiziert werden. Neben den tumorfördernden Funktionen dieses Eiweißes thematisiert die Arbeit des Teams um Elisabeth Heßmann insbesondere jene molekularen Voraussetzungen, die für eine erfolgreiche Anwendung von EZH2-Hemmstoffen als Teil der Behandlung des Bauchspeicheldrüsenkrebses gegeben sein müssten. Die Forschungsergebnisse zeigen, dass EZH2 das Wachstum und die Streuung von Tumorzellen begünstigt, indem es die Expression des GATA6-Gens unterdrückt.
GATA6 wirkt in der Bauchspeicheldrüse der Entstehung und dem aggressiven Wachstum von Tumoren entgegen. In manchen Subgruppen der Bauchspeicheldrüsentumoren findet sich jedoch eine Mutation des GATA6-Gens, durch die das Gen sich der Regulation durch EZH2 entzieht. In dieser Pankreaskarzinomsubgruppe ist die Hemmung von EZH2 somit nicht effektiv. „Wir müssen genau verstehen, wie epigenetische Regulatoren wirken und durch welche weiteren molekularen Veränderungen in der Tumorzelle ihre Funktionen beeinflusst werden, um Hemmstoffe dieser Eiweiße gezielt in der Behandlung von Bauchspeicheldrüsenkrebs anwenden zu können“, erläutert Elisabeth Heßmann die Bedeutung der bisherigen Forschungserkenntnisse für die Entwicklung neuer Therapiemöglichkeiten.
Mithilfe von Tumorzellen und Mausmodellen, die Bauchspeicheldrüsenkrebs entwickeln, wollten die Wissenschaftler im Rahmen des Forschungsprojektes auch verstehen, wie molekulare Veränderungen des p53-Gens die Funktion sowie die Hemmung epigenetischer Regulatoren beeinflussen. P53 reguliert Reparaturvorgänge an der DNA der Zelle, hindert Tumorzellen am Wachstum und wirkt somit ebenfalls einer Ausbreitung des Tumors entgegen. Bei etwa zwei Drittel aller Bauchspeicheldrüsenkrebspatienten liegt aber eine Mutation des p53-Gens vor. In diesen Fällen funktioniert der p53-Signalweg nicht mehr.
Die Zellen verlieren damit nicht nur ein wichtiges internes Notfallsystem, dass das Tumorwachstum einschränkt. Wie das Team um Elisabeth Heßmann nun herausfand, wirken in p53-mutierten Zellen darüber hinaus Hemmstoffe bestimmter epigenetischer Regulatoren nicht mehr oder fördern sogar das Tumorwachstum. „Es ist daher wichtig, vor dem Einsatz epigenetischer Hemmstoffe zu wissen, ob eine Veränderung des p53-Gens vorliegt“, erklärt Elisabeth Heßmann und ergänzt: „Werden bestimmte epigenetische Regulatoren gehemmt, wenn der Bauchspeicheldrüsenkrebs eine p53-Mutation aufweist, kann das sogar das Tumorwachstum begünstigen. Das gilt es unter allen Umständen zu vermeiden.“
Die Wissenschaftler hoffen nun, dass sie in anschließenden Forschungsprojekten das komplexe Zusammenspiel des molekularen Fingerabdrucks der Tumorzelle und epigenetischer Regulatoren weiter entwirren können, um zur Entwicklung neuer zielgerichteter Therapiestrategien in der Behandlung des Bauchspeicheldrüsenkrebses beizutragen.
Wilhelm Sander-Stiftung: Partner innovativer Krebsforschung
Die Wilhelm Sander-Stiftung hat dieses Forschungsprojekt mit rund 240.000 Euro unterstützt. Stiftungszweck ist die Förderung der medizinischen Forschung, insbesondere von Projekten im Rahmen der Krebsbekämpfung. Seit Gründung der Stiftung wurden insgesamt rund 245 Millionen Euro für die Forschungsförderung in Deutschland und der Schweiz ausbezahlt. Damit ist die Wilhelm Sander-Stiftung eine der bedeutendsten privaten Forschungsstiftungen im deutschen Raum. Sie ging aus dem Nachlass des gleichnamigen Unternehmers hervor, der 1973 verstorben ist.
Kontakt:
Henrike Boden
Wilhelm Sander-Stiftung
Presse- und Öffentlichkeitsarbeit & Stiftungskommunikation
Tel.: +49 (0) 89 544187-0
Fax: +49 (0) 89 544187-20
E-Mail: boden@sanst.de
Universitätsmedizin Göttingen
Die „Universitätsmedizin Göttingen (UMG)“ bündelt im Sinne des niedersächsischen Integrationsmodells unter einem Dach die Medizinische Fakultät und das Universitätsklinikum. Gemeinsam mit der Universität Göttingen ist die UMG seit dem Jahr 2003 Stiftungsuniversität. Die UMG ist einziger Maximalversorger in Südniedersachsen und fokussiert sich auf drei Forschungs- und klinische Schwerpunkte: Neurowissenschaften, Herz-Kreislauferkrankungen und Onkologie. Die UMG betreibt etwa 1.500 Planbetten, in 64 Kliniken und Instituten arbeiten rund 7.900 Beschäftigte. Rund 65.500 Patienten werden im Jahr stationär versorgt und etwa 233.000 ambulante Fälle betreut. Die Medizinische Fakultät an der UMG lehrt rund 3.500 Studierende in den Studiengängen Humanmedizin, Zahnmedizin, Molekulare Medizin, und Cardiovascular Science.
Kontakt:
Stefan Weller
Pressesprecher und Leiter Unternehmenskommunikation, Presse- und Öffentlichkeitsarbeit
Universitätsmedizin Göttingen, Georg-August-Universität
Von-Siebold-Str. 3
37075 Göttingen
Postfach
37099 Göttingen
Tel.: +49 (0) 551 39-61020
Fax: +49 (0) 551 39-61023
E-Mail: presse.medizin@med.uni-goettingen.de
Wissenschaftliche Ansprechpartner:
PD Dr. med. Elisabeth Heßmann
Klinik für Gastroenterologie, gastrointestinale Onkologie und Endokrinologie
Universitätsmedizin Göttingen, Georg-August-Universität
Robert-Koch-Straße 40
37075 Göttingen
Tel.: +49 (0) 551 39-62616
E-Mail: elisabeth.hessmann@med.uni-goettingen.de
https://gastroenterologie-goettingen.de/ag-hessmann
Originalpublikation:
Hessmann E, Buchholz SM, Demir IE, Singh SK, Gress TM, Ellenrieder V, Neesse A. Microenvironmental Determinants of Pancreatic Cancer. Physiol Rev. 2020 Oct 1;100(4):1707-1751. doi: 10.1152/physrev.00042.2019. Epub 2020 Apr 16.
https://doi.org/10.1152/physrev.00042.2019
Patil S, Steuber B, Kopp W, Kari V, Urbach L, Wang X, Küffer S, Bohnenberger H, Spyropoulou D, Zhang Z, Versemann L, Bösherz MS, Brunner M, Gaedcke J, Ströbel P, Zhang JS, Neesse A, Ellenrieder V, Singh SK, Johnsen SA, Hessmann E. EZH2 regulates pancreatic cancer subtype identity and tumor progression via transcriptional repression of GATA6. Cancer Res. 2020 Sep 9:canres.0672.2020. doi: 10.1158/0008-5472.CAN-20-0672. Epub ahead of print.
https://cancerres.aacrjournals.org/content/early/2020/09/09/0008-5472.CAN-20-067…
Weitere Informationen:
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Sensoren für „Ladezustand“ biologischer Zellen
Ein Team um den Pflanzenbiotechnologen Prof. Dr. Markus Schwarzländer von der Universität Münster und den Biochemiker Prof. Dr. Bruce Morgan von der Universität des Saarlandes hat Biosensoren entwickelt, mit denen…

Organoide, Innovation und Hoffnung
Transformation der Therapie von Bauchspeicheldrüsenkrebs. Bauchspeicheldrüsenkrebs (Pankreaskarzinom) bleibt eine der schwierigsten Krebsarten, die es zu behandeln gilt, was weltweite Bemühungen zur Erforschung neuer therapeutischer Ansätze anspornt. Eine solche bahnbrechende Initiative…

Leuchtende Zellkerne geben Schlüsselgene preis
Bonner Forscher zeigen, wie Gene, die für Krankheiten relevant sind, leichter identifiziert werden können. Die Identifizierung von Genen, die an der Entstehung von Krankheiten beteiligt sind, ist eine der großen…



