RUB-Wissenschaftler lösen das Rätsel basischer Lösungen
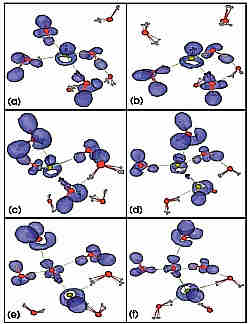
Die im Text besprochene Sequenz zeigt die Wanderung eines OH- Defekts in Wasser, wobei nur die nächsten Wassermoleküle gezeigt werden. Die blauen Wolken charakterisieren die wichtigsten chemischen Bindungen.
Elementare Annahmen als irreführend entlarvt
NATURE berichtet: Wie Reaktionen in Basen ablaufen
Die Übertragung von elektrischer Ladung in wässrigen Basen läuft anders ab, als Generationen von Wissenschaftlern bisher angenommen haben. Das konnten nach mehrjähriger Zusammenarbeit Mark Tuckerman (New York University), Dominik Marx (Fakultät für Chemie der RUB) und Michele Parrinello (Swiss Center for Scientific Computing, ETH Zürich) mit einem selbstgeschriebenen Computerprogramm und einem Großrechner zeigen. Sie fanden heraus, dass die einfachste Reaktion in Basen durch quantenmechanische Effekte beeinflusst wird. Zudem läuft sie nicht spiegelbildlich zu der in Säuren ab, so wie es seit fast 100 Jahren allgemein angenommen wurde. Über die Ergebnisse berichtet das Magazin NATURE in seiner heutigen Ausgabe.
Bisher unklar: Wie Basen genau funktionieren
Zunutze machen sich die Menschen die Reaktionsbedingungen in basischen Lösungen schon lange, etwa für einen der ältesten großchemischen Prozesse: die Seifenherstellung. Auch für die Biochemie und die organische Synthese sind basische Bedingungen wesentlich. Wie genau basische Lösungen auf atomistischer Ebene beschaffen sind, war jedoch bisher unklar. Basen (pH-Wert >7) zeichnen sich gegenüber neutralen Lösungen durch einen Überschuss von OH- Ionen aus. Sie sind die natürlichen Gegenspieler des H+ Ions, von dem Säuren (pH-Wert <7) einen Überschuss enthalten. In neutralen Lösungen wie Wasser herrscht ein Gleichgewicht zwischen beiden Ionen (pH-Wert = 7). Ionen verschieben ihre Ladung über H-Brücken
Chemische Reaktionen laufen i.d.R. in saurem und basischem Milieu ganz unterschiedlich ab. Seit langer Zeit ist bekannt, dass wässrige basische Lösungen elektrischen Strom extrem gut leiten, d.h. die überzähligen Ladungsträger OH- müssen eine sehr große Mobilität in Wasser besitzen. Die Wissenschaft weiß, dass nicht die OH- Ionen selbst wandern, sondern dass nur ihre Ladungen entlang von Wasserstoffbrückenbindungen verschoben werden. Dabei gingen die Forscher bisher davon aus, dass sich das OH- Ion spiegelbildlich analog zu dem besser untersuchten H+ Ion verhält.
Nach den Berechnungen: Umdenken
In Säuren befindet sich das H+ Ion oft zwischen zwei Wassermolekülen, schematisch [H2O…H…OH2 ]+. Es kann jedoch fast ohne Energieaufwand verschoben werden, wodurch ein H3O+ Molekül entsteht, das seinerseits über Wasserstoffbrücken von drei Wassermolekülen umgegeben ist, schematisch H3O+(H2O)3. Die Ladung wandert dabei gleich über mehrere Bindungslängen. Noch im Jahr 2000 erschien eine Arbeit, der die Annahme zugrunde lag, OH- und damit Basen verhielten sich genauso. Die analogen zwei Komplexe seien also [HO…H…OH]- und OH-(H2O)3. Die Forschergruppe um Prof. Marx entwickelte ein Computerprogramm, das sowohl die Elektronen als auch die Atomkerne quantenmechanisch beschreibt. Sein Einsatz auf einem Großrechner machte die althergebrachte Vorstellung anderer Forscher zunichte.
Das Tunneln beschleunigt die Reaktion
Es zeigte sich, dass das OH- Ion in Wasser nicht wie bisher angenommen von drei, sondern von vier Wassermolekülen umgeben ist (siehe Teilabbildung a). Dieses Phänomen bezeichnen die Wissenschaftler als „Hyperkoordination“. Damit ein H leicht verschoben werden kann, muss dieser Komplex zuerst ein Wassermolekül verlieren (siehe b und c), was ein relativ langsamer Schritt ist. Nach dieser „Aktivierung“ kann ein [HO…H…OH]- Komplex entstehen (siehe d), welcher sich nun wieder in ein von vier Wassermolekülen umgebenes OH- Ion umwandelt (siehe e und f). Nach diesen Umlagerungen ist der OH- Defekt um eine Wasserstoffbrückenlänge gewandert (vgl. f mit a). Dieser Komplex existiert in Basen allerdings nur als sog. „Übergangskomplex“ und ist damit nicht stabil wie im sauren Milieu. Die Forscher konnten schließlich zeigen, dass quantenmechanische Effekte, insbesondere das Tunneln eines Protons, die Umwandlung von OH-(H2O)3 merklich beschleunigen; dieser Effekt ist bei Säuren völlig vernachlässigbar. Ihr Fazit: das OH- Ion in Wasser verhält sich nicht wie das Spiegelbild von H+, womit die bisherigen Lehrbuch-Vorstellungen von wässrigen Basen über Bord zu werfen sind.
Titelaufnahme
M.E. Tuckerman; D. Marx; M. Parrinello: „The nature and transport mechanism of hydrated hydroxide ions in aqueous solution“ In: Nature (London), 27. Juni 2002.
Weitere Informationen
Prof. Dr. Dominik Marx, Lehrstuhl für Theoretische Chemie, Fakultät für Chemie der Ruhr-Universität Bochum, 44780 Bochum, Tel. 0234/32-28083, Fax: 0234/32-14045, E-Mail: dominik.marx@theochem.ruhr-uni-bochum.de,.
Media Contact
Weitere Informationen:
http://www.theochem.ruhr-uni-bochum.de/Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Größte bisher bekannte magnetische Anisotropie eines Moleküls gemessen
An der Berliner Synchrotronstrahlungsquelle BESSY II ist es gelungen, die größte magnetische Anisotropie eines einzelnen Moleküls zu bestimmen, die jemals experimentell gemessen wurde. Je größer diese Anisotropie ist, desto besser…

Tsunami-Frühwarnsystem im Indischen Ozean
20 Jahre nach der Tsunami-Katastrophe… Dank des unter Federführung des GFZ von 2005 bis 2008 entwickelten Frühwarnsystems GITEWS ist heute nicht nur der Indische Ozean besser auf solche Naturgefahren vorbereitet….

Resistente Bakterien in der Ostsee
Greifswalder Publikation in npj Clean Water. Ein Forschungsteam des Helmholtz-Instituts für One Health (HIOH) hat die Verbreitung und Eigenschaften von antibiotikaresistenten Bakterien in der Ostsee untersucht. Die Ergebnisse ihrer Arbeit…



