Grenzenlos im Einsatz
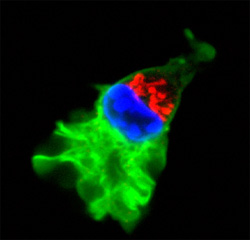
Das Bild zeigt den Aufbau eines Leukozyten, der sich nach rechts oben bewegt. Vorne sieht man grün angefärbt das fließende Aktin-Zellskelett, in der Mitte den blau angefärbten Zellkern und dahinter die dicht gepackten Zellorganellen. Bild: Michael Sixt/MPI für Biochemie
Die Fortbewegung von Zellen im Organismus ist streng reguliert und auf jeweils spezifische Gewebe beschränkt. Nur Leukozyten, die weißen Blutkörperchen, können auf der Suche nach Krankheitserregern und anderen Eindringlingen frei im Körper patrouillieren. Ein Forscherteam um Michael Sixt von der Abteilung für Molekulare Medizin am Max-Planck-Institut für Biochemie hat in Zusammenarbeit mit Wissenschaftlern der Medizinischen Hochschule Hannover und der Universität Leicester/Grossbritannien gezeigt, dass die Immunzellen diese Autonomie einer einfachen, aber äußerst effizienten Art der Fortbewegung verdanken. Anstatt fest am Untergrund anzudocken, fließen die Zellen vorwärts – und zwar durch dick und dünn. Bleiben sie wegen ihres relativ starren Zellkerns einmal stecken, dann wird dieser durch Kontraktionen eines zellulären Netzwerks durch den Engpass geschoben. (Nature, 1. Mai 2008)
Einen Tapetenwechsel hat die Natur für die Zellen unseres Organismus nicht vorgesehen. Sie dürfen nur genau vorgegebenen Pfaden folgen – für alles andere fehlt nämlich das richtige Schuhwerk. Als Grundlage der Fortbewegung galten bisher bei allen Zellen die so genannten Integrine. Als Transmembranproteine durchspannen diese die äußere Hülle der Zellen. Innen sind sie mit dem Zytoskeletts verbunden, einem äußerst flexiblen Gerüst aus Fasern, die nach Bedarf auf- und abgebaut werden. An der Außenseite aber sorgen die Integrine für Bodenhaftung. Denn an allen Oberflächen im Körper finden sich Moleküle, an die Integrine andocken können. Ein Trick ist allerdings dabei. „Es gibt 24 verschiedene Integrine“, sagt Sixt. „Jedes davon kann nur an ein genau passendes Gegenstück binden. Die unterschiedlichen Zelltypen tragen aber nicht alle Integrine in der Membran, sondern immer nur eine Kombination aus ein paar Vertretern. Wenn deren molekulare Partner in der Umgebung fehlen, können die Integrine nicht andocken, und die Zelle kommt nicht vorwärts.“ So ist sichergestellt, dass mobile Zellen in einer genau festgelegten Umgebung bleiben und nicht auf Abwege geraten.
Ein Sonderfall sind dabei die Leukozyten, die weißen Blutkörperchen. Diese Immunzellen müssen sich frei im Körper und dreidimensional in allen Gewebetypen bewegen können. Als „Gesundheitspolizei“ durchschwärmen sie nämlich unablässig den Organismus. Die Leukozyten müssen Krankheitserreger wie Bakterien und Viren, aber auch Parasiten, Toxine und selbst Tumorzellen aufspüren und unschädlich machen. Auch Leukozyten tragen Integrine in der Membran, doch können sie bis zu 100-mal schneller als andere bewegliche Zellen im Körper unterwegs sein. Dieses Tempo übersteigt die Kapazität der Integrin-vermittelten Fortbewegung bei weitem. „Es war also klar, dass die Mobilität der weißen Blutkörperchen nicht auf diesem Mechanismus alleine beruhen kann“, sagt Sixt. „Wir haben deshalb im Mausmodell Leukozyten hergestellt, die keine Integrine mehr produzieren“, berichtet Sixt. „Zu unserer Überraschung konnten sich die Zellen trotzdem unvermindert bewegen. Das widerspricht eigentlich der gängigen Lehrbuchmeinung, nach der Integrine als Grundlage jeder zellulären Mobilität gelten. Bei den Leukozyten scheinen sie aber höchstens eine untergeordnete Rolle zu spielen.“
Weitere Untersuchungen bestätigten dann, dass die Migration von Leukozyten im Gewebe unabhängig von den Integrinen und unabhängig von der molekularen Zusammensetzung der Umgebung verläuft – also völlig autonom ist. Tatsächlich genügt den Leukozyten das Aktinnetzwerks in ihrem Inneren. Diese wichtigen Bestandteile des Zellskeletts bildet lange Fasern aus, deren Wachstum eine Art Fließen des vorderen Zellbereichs in die gewünschte Richtung bewirkt – und so die zelluläre Bewegung vorantreibt. „Nur bei Engpässen im Gewebe kann es passieren, dass der starre Zellkern die reibungslose Passage blockiert“, meint Sixt. „Dann kontrahieren am Hinterende Fasern des Zytoskeletts, die den Zellkern durch die enge Stelle zwängen.“ Das ähnelt ein wenig einem Drahtkorb, der sich zusammenzieht. Die Fasern am Vorder- und Hinterende der Zelle arbeiten dabei getrennt. „Wenn wir diejenigen hemmen, die hinten aktiv sind, strecken sich die Zellen manchmal um das 30fache ihrer normalen Länge: Das Vorderende wandert also einfach weiter, obwohl das Hinterende wegen des Zellkerns irgendwo steckengeblieben ist“, so der Zellbiologe.
Auch das ist ein Unterschied zur Integrin-vermittelten Variante der Fortbewegung. Hier docken nämlich die aktivierten Integrine am Vorderende der Zelle an ihre molekularen Gegenstücke in der Umgebung an und verhaften so die Zelle am Untergrund. Kontraktionen der Aktinfasern im Inneren ziehen diese dann nach vorne. Nach jedem „Schritt“ werden die Integrine am Hinterende dann inaktiviert, weil ihre Verbindung unnötig geworden ist und ein weiteres Vorankommen verhindern würde. Die beiden Vorgänge in den verschiedenen Zellbereichen sind dabei gekoppelt und laufen koordiniert ab. Insgesamt kommt die Zelle nur in einer zähen Bewegung voran. „In gewisser Weise klebt die Zelle am Untergrund und verschmilzt dank der Integrine mit ihrer Umgebung“, sagt Sixt. „Bei der Fortbewegungsart der Leukozyten dagegen geht die Zelle keine feste Verbindung mit ihrer Umwelt ein. Das Wachstum ihrer Aktinfasern nach vorne genügt, um die Zelle zu mobilisieren.“
Die weißen Blutkörperchen verändern wegen der Fließbewegung ständig ihre äußere Gestalt – und ähneln damit den Amöben. Das ist kein Zufall, denn auch diese Einzeller bewegen sich auf diese Weise. Ähnlich wie die Amöben verleiht dieser Mechanismus auch den weißen Blutkörperchen völlige Autonomie. Eine interessante Frage ist nun, warum nicht alle Zellen im Körper diese Variante der Fortbewegung nutzen, die ja sehr viel einfacher ist als der Integrin-vermittelte Mechanismus. Die Voraussetzungen wären gegeben: Schließlich verfügen alle Zellen über ein Zytoskelett. „Die Leukozytenbewegung ist primitiv und dennoch ausgesprochen effizient“, meint Sixt. „Die Adhäsion durch die Integrine schafft aber Ordnung. Und das ist wichtig, weil Zellen nicht ihre Gewebeidentität verlieren sollen. Sie sollen gar nicht über völlige Bewegungsfreiheit verfügen.“ Und das gilt natürlich in besonderem Maße für Krebszellen, die sonst streuen könnten. Tatsächlich gibt es bereits Hinweise, dass manche Tumorzellen diese Art der Fortbewegung für sich nutzen können – und das scheint sie besonders gefährlich zu machen.
Originalveröffentlichung:
Tim Lämmermann, Bernhard L. Bader, Susan J. Monkley, Tim Worbs, Roland Wedlich-Söldner, Karin Hirsch, Markus Keller, Reinhold Förster, David R. Critchley, Reinhard Fässler & Michael Sixt
Rapid leukocyte migration by integrin-independent flowing and squeezing
Media Contact
Weitere Informationen:
http://www.mpg.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Tropfsteine geben Auskunft über die Dynamik des Klimas in Europa
Geowissenschaftler untersuchen Stalagmiten in rumänischer Höhle, um regionale Niederschlagsmuster zu rekonstruieren. Dynamische Prozesse in der atmosphärischen Zirkulation wie der Nordatlantische Jetstream haben Einfluss auf regionale Veränderungen des Niederschlags. Das zeigen…

Torffreie Blumenerde soll Moore schützen
Herkömmliche Blumenerden und andere Gartensubstrate enthalten meist Torf, der aus Mooren gewonnen wird. Der Torfabbau setzt jedoch große Mengen CO2 frei. Um Moore, die darin vorhandene Artenvielfalt und das Klima…

Erwärmung verschärft Sauerstoffmangel in der westlichen Ostsee
Steigende Wassertemperaturen zehren Erfolge bei der Nährstoffverringerung auf. Überdüngung und steigende Wassertemperaturen setzen der Ostsee immer mehr zu: Sie führen zu einem gefährlichen Sauerstoffmangel in den tieferen Wasserschichten, was viele…



