Markierungsfreie Echtzeitanalysen von biomolekularen Interaktionen
Nach der Aufklärung des Genoms vieler Organismen rückt heute die Frage nach der Wirkungsweise von Proteinen und deren Interaktion mit ihren Bindungspartnern immer mehr in den Vordergrund. Die kinetische Analyse des Netzwerks an Interaktionen in einer Zelle stellt einen eigenen Zweig der neuen Forschungsfelder „functional Genomics“ und „Proteomics“ dar.
Der Einsatz von Biosensoren basierend auf Oberflächen Plasmonresonanz (surface plasmon resonance SPR) ist ein exzellentes Werkzeug für markierungsfreie Echtzeituntersuchungen beliebiger biomolekularer Wechselwirkungen (biomolecular interaction analysis BIA). Ein entscheidender Vorteil von kinetischen Analysen mit SPR basierten Biosensoren gegenüber der klassischen steady-state-Analyse ist die separate Bestimmung von Assoziations- und Dissoziationsgeschwindigkeitskonstanten.
Vielfältige biologische Anwendungen inklusive einer detaillierten Analyse von Antigen-Antikörper-Wechselwirkungen sind möglich. Mit den gewonnenen Daten ergeben sich neue Möglichkeiten in der Entwicklung pharmazeutischer Wirkstoffe, der Charakterisierung humaner Pathogene und der Entwicklung therapeutischer Antikörper.
Weitere analytische Fragestellungen, bei denen die BIA-Technologie eingesetzt werden kann, sind beispielsweise:
- Wie interagieren Proteine miteinander?
- Wie wechselwirken einzelne Domänen?
- Wie wirken Co-Faktoren und andere kleine Moleküle mit Proteinen?
- Wie funktionieren katalytische Domänen?
- Welche Aminosäuren sind direkt an der Proteinbindung beteiligt?
- Welche Erkennungssequenzen gibt es zur Wechselwirkung mit anderen Molekülen?
- Wie interagieren Transkriptionsfaktoren mit DNA?
- Wie funktioniert Genregulation auf molekularer Ebene?
- Haben synthetische Nukleinsäureoligonukleotide gleiche Hybridisierungseigenschaften wie die natürlichen Nukleinsäuren?
- Welche Bindungseigenschaften hat mein neuer Antikörper?
Dieser Fragenkatalog für biomolekulare Wechselwirkungen lässt sich beliebig fortsetzen.
Die Biomolekulare Interaktionsanalyse kann bei der Klärung vieler dieser Aufgaben helfen.
Das Messprinzip
Das Messsystem besteht aus einem Sensor-Chip, einem optischen System für die Erzeugung und Detektion des SPR-Signals und einem integrierten Mikrofluss-System, dass den Transport der Proben über die Sensoroberfläche kontrolliert. Über einen Autosampler können die Proben automatisch in das Fluss-System injiziert werden.
Der Sensor-Chip besteht aus einer Glasscheibe, auf die eine dünne Goldschicht aufgebracht worden ist. Auf diese Goldoberfläche wurde eine biospezifische Matrix angebracht, die für die meisten Anwendungen aus carboxymethyliertem Dextran besteht. An dieses hydrophile Material können Biomoleküle als Ligand kovalent gekoppelt werden.
Der zweite Bindungspartner (der Analyt) wird mit Hilfe des Mikrofluss-Systems über diese Oberfläche geleitet, wobei die Wechselwirkung direkt “online” durch das Phänomen der Oberflächen Plasmonresonanz (surface plasmon resonance SPR) in Echtzeit verfolgt werden kann. Das Detektionssystem besteht aus einer LED, die Licht im nahen Infrarotbereich ausstrahlt, einem am Sensorchip fixiertem Glasprisma und einem positionsempfindlichen Diodenarraydetektor. Der refraktive Index der Chip-Oberfläche und damit auch das SPR-Signal ändert sich proportional zur Masse des gebundenen Analyten (ausreichende Empfindlichkeit selbst für kleine Moleküle ab 200 Dalton). Dieser Messwert wird in „response units“ RU angegeben, der ein direktes Maß für die Menge an gebundenem Analyten auf der Sensorchip-Oberfläche ist.
Der große Vorteil dieser Methode ist, dass sie ganz ohne Markierungen der Biomoleküle auskommt.
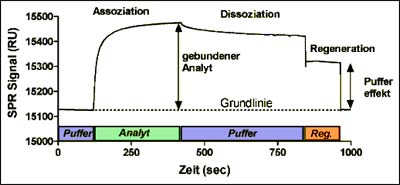
Beispiel einer Interaktionsanalyse
Die Abbildung (siehe oben) zeigt den typischen Verlauf einer biomolekularen Interaktionsanalyse. Während der Injektion des Analyten sieht man einen deutlichen Anstieg des SPR-Signals, was eine Bindung des Analyten an den auf der Biosensor-Oberfläche immobilisierten Liganden anzeigt. Aus der Kurvenform, der resultierenden Signalhöhe und den Konzentrationen des injizierten Analyten in einer Konzentrationsreihe können neben der Bestimmung der Stöchiometrie der Bindung sowohl Bindungsstärke (Affinität, KD-Wert) als auch die Geschwindigkeitskonstanten für Assoziation (kass) und Dissoziation (kdiss) berechnet werden. Damit sind auch Aussagen über die Geschwindigkeit der Komplexbildung und des Komplexzerfalls möglich.
Um die Dissoziationsphase in Vorbereitung weiterer Messungen abzukürzen, wird eine Regenerationslösung injiziert, die den gebundenen Analyten wieder von der Oberfläche entfernt. Idealerweise erhält man eine vollständige Regeneration ohne Verlust der Bindungsaktivität des immobilisierten Liganden, so dass mehrere Messreihen mit einem Biochip möglich sind.
Durch den Aufbau des Microchips mit vier parallelen Flusszellen ist es zum einen möglich, zeitgleich auf einer Kontrolloberfläche unspezifische Oberflächenbindung zu detektieren, zum anderen ist eine simultane Analyse mehrerer Liganden (z.B. verschiedene Isoformen oder Punktmutationen in Proteinen, verschiedene Präperationen, etc.) in direktem Vergleich möglich.
Vorteile der BIA-Technologie
- anwendbar für alle Arten von Biomolekülen: Proteine (Enzyme, Antikörper), Peptide, Lipidmembranen, Nukleinsäuren (DNA, RNA, PNA), niedermolekulare Substanzen, Zellen, …
- Bestimmung von Affinitäten und Ratenkonstanten
- minimaler Probenverbrauch
- akkurat und reproduzierbar
- keine Markierung der Interaktionspartner notwendig
- Echtzeit-Detektion
- Elution von gebundenem Material zur Identifizierung durch Massenspektrometrie
Unser Service-Angebot
Die Firma Biaffin GmbH & Co KG bietet Ihnen die Untersuchung von biomolekularen Interaktionen (BIA) als Servicedienstleistung an. Unser Angebot umfasst neben der qualitativen und quantitativen Antikörpercharakterisierung und Untersuchungen beliebiger Protein-, Peptid- und Nukleinsäureinteraktionen weitere Anwendungen aus den Bereichen Proteomics, Wirkstoffentwicklung (drug development), Prozessoptimierung und moderner Oberflächenentwicklung. Für die Entwicklung Ihres spezifischen Assays setzen Sie sich mit uns in Verbindung, wir helfen Ihnen gerne weiter.
Media Contact
Weitere Informationen:
http://www.innovations-report.de/html/profile/profil-1117.html http://www.biaffin.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Sensoren für „Ladezustand“ biologischer Zellen
Ein Team um den Pflanzenbiotechnologen Prof. Dr. Markus Schwarzländer von der Universität Münster und den Biochemiker Prof. Dr. Bruce Morgan von der Universität des Saarlandes hat Biosensoren entwickelt, mit denen…

Organoide, Innovation und Hoffnung
Transformation der Therapie von Bauchspeicheldrüsenkrebs. Bauchspeicheldrüsenkrebs (Pankreaskarzinom) bleibt eine der schwierigsten Krebsarten, die es zu behandeln gilt, was weltweite Bemühungen zur Erforschung neuer therapeutischer Ansätze anspornt. Eine solche bahnbrechende Initiative…

Leuchtende Zellkerne geben Schlüsselgene preis
Bonner Forscher zeigen, wie Gene, die für Krankheiten relevant sind, leichter identifiziert werden können. Die Identifizierung von Genen, die an der Entstehung von Krankheiten beteiligt sind, ist eine der großen…



