Kein Treibhausgas aus dem Meeresboden
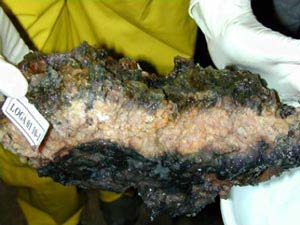
Abb. 1: Proben aus dem Schwarzen Meer: Ein Stück dieser Schlote konnten die Forscher mit einem Tauchboot aus 200 Meter Tiefe bergen und später daraus das neue Enzym isolieren. <br> <br>Bild: Projekt Ghostdabs, Universität Hamburg <br>
Forscherteam aus drei Max-Planck-Instituten identifiziert ungewöhnliches Enzym in Nickel-Bakterien, dass das Klimagas Methan im Meeresboden entsorgt
Methan ist wie Kohlendioxid ein Treibhausgas. Es entsteht im Meeresboden in riesigen Mengen beim Verwesen organischen Materials und könnte als Gas in die Atmosphäre aufsteigen. Erst kürzlich hat man entdeckt, dass eine natürliche Barriere aus Mikroorganismen dies verhindert. Bei der Entschlüsselung dieses komplexen Prozesses der Methan-Entsorgung ist man jetzt eine großen Schritt weiter gekommen: Max-Planck-Forschern aus Marburg, Berlin und Bremen ist es gelungen, jenen Biokatalysator zu identifizieren und zu isolieren, der das Kunststück fertig bringt, das eigentlich chemisch träge Methan im Meer bei Normaltemperaturen und ohne Sauerstoff unschädlich zu machen (Nature, 18./25. Dezember 2003).
Methan ist ein häufig vorkommendes natürliches Gas. Es ist Hauptbestandteil von Erdgas, das wir als Energielieferanten nutzen, und von Sumpfgas, das aus stehenden Gewässern und Reisfeldern in die Luft entweicht. Dieser Ausstoß in die Atmosphäre gibt Anlass zu Sorgen: Denn Methan ist wie Kohlendioxid ein Klimagas, das infrarote Strahlung abfängt und zur globalen Erwärmung beiträgt.
Doch seit wenigen Jahren gilt einer weiteren Gasquelle vermehrt die Aufmerksamkeit von Geologen, Klimaforschern und Biologen, nämlich dem im Meeresboden gebildeten und gespeicherten Methan. Seine Mengen übertreffen sogar die der fossilen Brennstoffe bei weitem. Trotz ständiger Neubildung und Wanderung zur Oberfläche des Meeresbodens gelangen zum Glück keine größeren Methanmengen aus dem Meer in die Atmosphäre. Spezielle Mikroorganismen unter der Oberfläche des Meeresbodens oxidieren nämlich das Methan, bevor es ins freie Wasser gelangen kann (vgl. Abbildung 1 und 2). Dieser Oxidationsvorgang, so wichtig und weit verbreitet er auch ist, ist dennoch alles andere als verstanden (s. Link 1, „Methanfresser im Ozean“). So gibt es Befunde, wonach dieser Prozess von zwei in Symbiose lebenden Mikroorganismen gesteuert wird. Schon länger ist bekannt, dass in der Zone der Methanoxidation kein Sauerstoff vorhanden ist und für die Mikroorganismen nur das im Meerwasser enthaltene Sulfat als Oxidationsmittel zur Verfügung steht. Das Sulfat wird dabei zu Schwefelwasserstoff reduziert. Schwefelwasserstoff ist für höhere Lebewesen zwar sehr giftig, wird aber durch andere Mikroorganismen etwas weiter oben im Kontakt mit dem freien Meerwasser sehr schnell und vollständig reoxidiert.
Doch ungelöste Fragen gibt es noch reichlich: Sulfat ist ein viel schwächeres Oxidationsmittel als Sauerstoff. Somit liefert die Methanoxidation mit Sulfat auch sehr, sehr wenig Energie für die Zellen, und es erstaunt, wie die Mikroorganismen mit dieser Niedrigstkalorien-Kost überhaupt ihr Leben fristen können. Doch damit nicht genug: Methan ist eine äußerst reaktionsträge Substanz. Die Formel des Methanmoleküls ist CH4, d.h. es besteht aus einem Atom Kohlenstoff (C) und vier Atomen Wasserstoff (H), die das Kohlenstoffatom symmetrisch umgeben und abschirmen, so dass es chemisch schwer angreifbar ist. Es stimmt zwar, dass Methan-Luft-Gemische sehr heftig explodieren können, aber diese von Sauerstoff abhängige Reaktion braucht eine glühend-heiße Zündung und läuft bei mehreren hundert Grad Celsius ab. Hingegen ist der Meeresboden dort, wo Methan oxidiert wird, kalt und enthält keinen Sauerstoff. In der Chemie kennt man zwar auch einige Reaktionen von Methan, die keiner Initialzündung und keines Sauerstoffs bedürfen, dafür aber anderweitig sehr extreme Verhältnisse wie z.B. hoch konzentrierte Schwefelsäure und einen besonderen Katalysator erfordern. Die Mikroorganismen schaffen es aber offensichtlich spielend, das Methan ohne extreme Retortenbedingungen umzusetzen.
Lange hat man über das Enzym, sprich den Biokatalysator spekuliert, mit dem die Mikroorganismen das widerspenstige Methan aufschließen. Diesem Biokatalysator sind Wissenschaftler an den Max-Planck-Instituten für terrestrische Mikrobiologie in Marburg, marine Mikrobiologie in Bremen und molekulare Genetik in Berlin nun offensichtlich auf die Spur gekommen. Eine Schwierigkeit bestand darin, dass man die methanoxidierenden Mikroorganismen bisher nicht im Labor züchten konnte, was sonst immer eine Voraussetzung für biochemische Untersuchungen war. Möglich wurde die Erforschung des ungewöhnlichen Enzyms dennoch – durch eine gemeinsame Expedition ins Schwarze Meer mit Wissenschaftlern der Universität Hamburg. Während dieser Expedition spürten die Wissenschaftler Unterwassergebiete in 200 Metern Tiefe auf, wo Methan in schlotähnlichen Gebilden nach oben steigt (vgl. Link 2 „Riffe aus Bakterien entdeckt“).
Diese Schlote sind so dicht mit pelzigen Belägen – Matten aus methanoxidierenden Mikroorganismen – bewachsen, die genügend Substanz für biochemische Untersuchungen im Labor liefern. Über spezielle Extraktions- und Trennverfahren ließ sich aus den Matten ein auffälliges Protein isolieren, das in seiner Menge alle anderen darin vorkommenden Proteine übertraf und daher eine zentrale Rolle in den dortigen Mikroorganismen spielen musste. Weitere Analysen ergabeb, dass dieses Protein Nickel enthält, ein Metall, das im Vergleich zu dem häufigen Biometall Eisen relativ selten in Zellen aller Art vorkommt. Allerdings weiß man schon lange, dass Nickel auch etwas mit dem umgekehrten Prozeß, also der Bildung von Methan, zu tun hat. Denn der Biokatalysator in den Mikroorganismen, der zur Freisetzung von Methan in Sümpfen, Reisfeldern oder Sedimenten führt, ist ebenfalls ein Nickel-haltiges Protein. Der Vergleich der beiden Proteine zeigte große Ähnlichkeiten. Aus allen diesen Beobachtungen schlossen die Forscher, dass es sich bei dem in den Matten so häufig vorkommenden Protein um das gesuchte Enzym für den Verdau von Methan handelt.
Damit konnte die Suche nach dem Gen für dieses Protein bzw. Biokatalysator beginnen. Diese gestaltete sich schwierig, weil das Ausgangmaterial mit einer unbekannten Anzahl von anderen Organismen verunreinigt war und deshalb Erbinformationen vieler Bakterien enthielt. Den Forschern gelang es bis heute nicht, die Mikroorganismen aus der Mikrobenmatte aufzureinigen und eine Reinkultur zu erzeugen, um sie dann nach allen Regeln der Kunst untersuchen zu können. Das war keine Überraschung, denn auch viele andere in der Umwelt vorkommenden Mikroorganismen kann man im Labor nicht zum Wachsen bringen. Trotz dieser Schwierigkeiten konnten die Forscher die „Stecknadel“ in diesem genetischen „Heuhaufen“ finden – das vollständige Gen für das Nickel-haltige Protein. Sie nutzten dafür Techniken aus der Genomanalyse, die bisher vor allem in der Medizin und Biotechnologie eingesetzt wurden.
Mit dieser „Umweltgenomik“ waren die Wissenschaftler in der Lage, einen großen vollständigen Genomabschnitt, ein so genanntes Contig, aus der Umwelt ins Labor holen. Im Gegensatz zum klassischen Ansatz braucht man dazu keine aufgereinigten Bakterien, sondern „zäumt das Pferd von hinten auf“. Die Forscher schredderten zuerst grob die gesamte Erbsubstanz der Umweltprobe und suchten dann gezielt nach Contigs mit den wesentlichen Genen. Diese Stücke wurden dann gelesen („sequenziert“) und mittels Bioinformatik interpretiert. Im Ergebnis konnten sie einem bisher nicht isolierten Archaebakterium zugeordnet werden. Mit dieser neuartigen Methode eröffnen sich mit einem Schlag neue Perspektiven. Zunehmend wird es möglich, nicht nur das Genom eines einzelnen Organismus, sondern den gesamten Genpool, d.h. alle Gene aller Organismen eines Habitats zu studieren: Seien es die Lebensgemeinschaften an extremen Standorten wie in der Arktis oder an heißen Thermalquellen oder auch ganz normale Standorte wie das Wattenmeer.
Die Methode funktionierte erfolgreich bei den Methan-oxidierenden Mikrobenmatten aus dem Schwarzen Meer. Als die beteiligten Forscher die Gene analysierten, die die Erbinformation für die Bildung des Nickel-haltigen Proteins tragen, fanden sie eine auffallende Ähnlichkeit mit der Erbinformation für das Methan-bildende Enzym. Warum dieses Enzym für den „Vorwärtsgang“, also die Methanbildung, und das neu gefundene Protein für den „Rückwärtsgang“, also die Methanoxidation, geeignet ist, ist noch unklar. Dabei mutet diese Biochemie wie ein Paradoxon an: Methan ist ein sehr kleines, einfaches Molekül, viel kleiner und einfacher als z.B. Rohrzucker. Mit der Biochemie verhält es sich aber ganz offensichtlich umgekehrt: Der biochemische Abbau von Rohrzucker ist wohlbekannt und einfach zu verstehen, während alle biochemische „Prozesse ums Methan“ den Biologen zum Grübeln und den Chemiker zum Staunen bringen. Doch ist dieses kein Staunen und Grübeln im Elfenbeinturm: Für die chemisch-technische Verwertung von Methan wäre ein Katalysator nach einem Prinzip, wie es die Mikroorganismen in den Matten seit Jahrmillionen anwenden, eine große Innovation. Auch das „neue“ Nickel-Enzym selbst hat eigentlich nichts Exotisches: Angesichts des hohen Prozentsatzes, mit dem es in den Mikroorganismen enthalten ist, und angesichts der riesigen Flächen im Meer, wo Methan oxidiert wird, kann man es sicherlich als eines der weltweit häufigsten Enzyme mit einer Schlüsselfunktion im Stoffkreislauf der Meere bezeichnen.
Originalveröffentlichung:
Martin Krüger, Anke Meyerdierks, Frank Oliver Glöckner, Rudolf Amann, Friedrich Widdel, Michael Kube, Richard Reinhardt, Jörg Kahnt, Reinhard Böcher, Rudolf K. Thauer, Seigo Shima
A conspicuous nickel protein in microbial mats that oxidise
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Sensoren für „Ladezustand“ biologischer Zellen
Ein Team um den Pflanzenbiotechnologen Prof. Dr. Markus Schwarzländer von der Universität Münster und den Biochemiker Prof. Dr. Bruce Morgan von der Universität des Saarlandes hat Biosensoren entwickelt, mit denen…

Organoide, Innovation und Hoffnung
Transformation der Therapie von Bauchspeicheldrüsenkrebs. Bauchspeicheldrüsenkrebs (Pankreaskarzinom) bleibt eine der schwierigsten Krebsarten, die es zu behandeln gilt, was weltweite Bemühungen zur Erforschung neuer therapeutischer Ansätze anspornt. Eine solche bahnbrechende Initiative…

Leuchtende Zellkerne geben Schlüsselgene preis
Bonner Forscher zeigen, wie Gene, die für Krankheiten relevant sind, leichter identifiziert werden können. Die Identifizierung von Genen, die an der Entstehung von Krankheiten beteiligt sind, ist eine der großen…



