Bewegte Ladungen – Strahlung lässt Moleküle tanzen
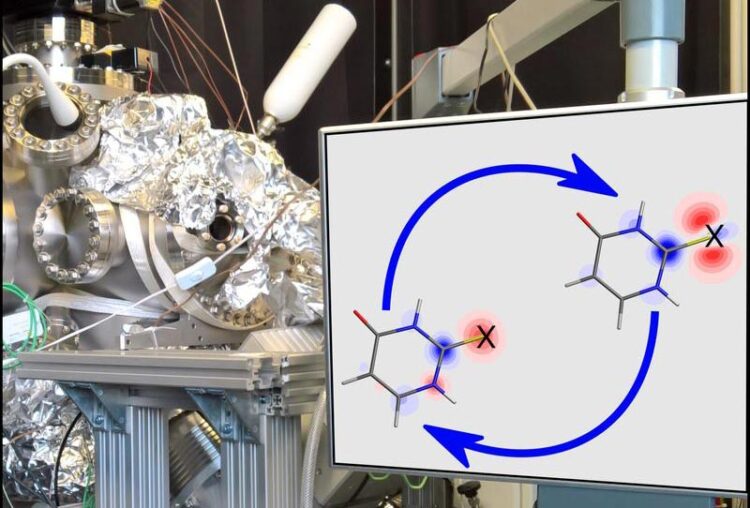
Ein Team um Prof. Dr. Markus Gühr hat Ladungsbewegungen in lichtangeregten Molekülen von Thiouracil, einer modifizierten Nukleobase, beobachtet.
(c) Treusch/Picconi/Gühr
Ein internationales Team unter Leitung der Forschungsgruppe von Prof. Dr. Markus Gühr im Institut für Physik und Astronomie der Universität Potsdam hat Ladungsbewegungen in lichtangeregten Molekülen von Thiouracil, einer modifizierten Nukleobase, beobachtet. Diese Klasse von Molekülen hat eine Vielzahl von medizinischen Anwendungen, einschließlich möglicher neuer Krebstherapien. Die Ergebnisse der am Deutschen Elektronen-Synchrotron DESY durchgeführten Laserexperimente wurden jetzt in der Fachzeitschrift Nature Communications publiziert. Sie eröffnen neue Möglichkeiten, die Ladungsflüsse innerhalb der Moleküllandschaft zu kartieren.
Nahezu alle Energiequellen sind auf die Sonne als primäre Quelle angewiesen. Die Natur ist reich an effizienten und ökonomischen molekularen Maschinen, die Lichtenergie in veränderte chemische Bindungen, elektrischen Strom oder Wärme umwandeln können. Auf mikroskopischer Ebene erfolgt die Umwandlung des absorbierten Lichts in andere Energieformen durch einen elektrischen Ladungsfluss in den Molekülen.
Das hier untersuchte Molekül Thiouracil (C4H4N2OS) gehört zur Klasse der Thiobasen. Diese Moleküle werden aus den natürlich vorkommenden Nukleobasen – welche genetische Informationen zu DNA und RNA kodieren – gewonnen, indem ein oder mehrere Sauerstoffatome durch Schwefel ersetzt werden. Thiobasen haben eine Vielzahl von Anwendungsmöglichkeiten, wie z.B. Medikationen, die das Immunsystem nach Organtransplantationen herunterfahren, und möglicherweise auch die photoinduzierte Krebstherapie zur Zerstörung von Tumorzellen. Reguläre Nukleobasen leiten die durch UV-Anregung erhaltene Energie schnell ab und vermeiden so potenzielle Mutationen. Werden Thiobasen mit UV-Licht bestrahlt, gehen sie stattdessen in angeregte Zustände über, was zur Bildung einer reaktiven Form von Sauerstoff in der Nähe des Moleküls führt.
Das Team nutzte die Empfindlichkeit der Röntgen-Photoelektronen-Spektroskopie für bestimmte Atome innerhalb eines Moleküls, um lichtangeregtes Thiouracil auf einer Femtosekunden-Zeitskala (1 Femtosekunde = 10-15 s) zu untersuchen. Ein erster ultravioletter (UV) Lichtpuls regte Thiouracil an und löste eine ultraschnelle Ladungsbewegung innerhalb des Moleküls aus. Ein zweiter verzögerter Röntgenpuls ionisierte bestimmte Elektronen, die sich stark am Schwefelatom des Moleküls konzentrierten. Die Autoren beobachteten zeitabhängige Veränderungen in der Energie dieser Photoelektronen, die direkt den Ladungsfluss vom und zum Schwefelatom widerspiegeln.
David Picconi, theoretischer Chemiker und einer der korrespondierenden Autoren der Studie, fand den direkten Zusammenhang zwischen der Photoelektronenenergie und den Ladungsänderungen: „Wir haben modernste quantenchemische Berechnungen auf viele verschiedene molekulare Strukturen angewandt“, sagt er, „und dabei festgestellt, dass die UV-Anregung die Elektronendichte in der Nähe des Schwefelatoms verringert und durchweg zu einer niedrigeren Energie der durch die Röntgenstrahlen ausgestoßenen Photoelektronen führt. Das ist verständlich, denn bei geringerer Elektronendichte ist die Coulomb-Anziehung des Schwefelkerns stärker, ein höherer Anteil der Röntgenenergie wird für die Ionisation benötigt, und dem Photoelektron bleibt weniger Energie.“ Dieser Zusammenhang zwischen lokaler Ladung und Photoelektronenspektroskopie wurde bereits vom schwedischen Nobelpreisträger Kai Siegbahn für Moleküle ohne Lichtanregung formuliert. Die Autoren wenden nun genau dieselben Konzepte auf den lichtangeregten Zustand von Molekülen an.
Die experimentelle Studie erhellt den mikroskopischen Mechanismus, warum Thiobasen in potenziell schädliche Zustände übergehen. Dieser Prozess erwies sich als ziemlich komplex. Dennis Mayer, einer der Erstautoren der Publikation, bemerkt: „Unser erster Blick auf das Photoelektronensignal während des Experiments offenbarte keine besonders detaillierten Merkmale. Freie-Elektronen-Laser weisen viele Fluktuationen auf, aber glücklicherweise gibt es auch Diagnosemöglichkeiten, um diese zu messen. Die spätere Korrektur ergab schöne zeitabhängige Oszillationen in der kinetischen Energie der Photoelektronen.“ Die oszillierende Photoelektronenenergie und damit die oszillierende Ladung am Schwefelatom deutet darauf hin, dass das Molekül zwischen verschiedenen elektronischen Konfigurationen hin und her springt, bevor es sich schließlich im angeregten Zustand einpendelt.
Das Team führte die Studie an der Free-Electron Laser Facility FLASH 2 des DESY in Hamburg durch, in einer nach Kai Siegbahn benannten Experimentierhalle. Dort hatte die Potsdamer Gruppe die einmalige Chance, gemeinsam mit der FLASH-Facility ein neues Instrument für diese Art von Forschung zu bauen. Möglich wurde dies durch Drittmittel des Bundesministeriums für Bildung und Forschung. Fabiano Lever, einer der Erstautoren der Arbeit, berichtet: „Es war das erste Mal, dass ich an einem solchen Gemeinschaftsexperiment in einer großen Einrichtung teilgenommen habe, und ich hatte viel Spaß beim Bau des Instruments, vor allem bei der Arbeit an der Schnittstelle zu einer so großen und komplizierten Maschine wie FLASH.“
Die Arbeiten an FLASH wurden von einem internationalen Zusammenschluss von Wissenschaftlern aus Potsdam, vom DESY, der Universität Hamburg und dem Center for Free-Electron Laser Science, dem Heidelberger Institut für Theoretische Studien, der Universität Göteborg, dem European XFEL und dem SLAC National Accelerator Laboratory durchgeführt. Markus Gühr freut sich auf weitere spannende Experimente: „Bisher haben wir die Ladungsdynamik nur aus dem Blickwinkel eines bestimmten Atoms im Molekül betrachtet. Wenn wir dies auf verschiedene Atome ausdehnen, können wir eine vollständige dynamische Karte des Ladungsflusses innerhalb der Moleküllandschaft erstellen.“
Link zur Publikation: Mayer, D., Lever, F., Picconi, D. et al. Following excited-state chemical shifts in molecular ultrafast x-ray photoelectron spectroscopy. Nat Commun 13, 198 (2022).
https://www.nature.com/articles/s41467-021-27908-y
Abbildung: Teil des Instruments, das für die Untersuchung bei FLASH verwendet wurde. Der Monitor zeigt die durch ultraviolette Anregung induzierte Ladungsdichte (rot bedeutet weniger Elektronen, blau bedeutet mehr) im Molekül 2-Thiouracil. Das X auf der Struktur markiert das Schwefelatom, an dem die Autoren den Ladungsfluss mit zeitauflösender Röntgen-Photoelektronen-Spektroskopie untersucht haben. Das Molekül springt in den ersten 100 Femtosekunden zwischen den beiden angegebenen Elektronenkonfigurationen hin und her. Bildrechte: Rolf Treusch (DESY), David Picconi und Markus Gühr (UP)
Kontakt: Prof. Dr. Markus Gühr, Institut für Physik und Astronomie
Telefon: 0331 977-5571
E-Mail: markus.guehr@uni-potsdam.de
Medieninformation 12-01-2022 / Nr. 002
Prof. Dr. Markus Gühr/Dr. Stefanie Mikulla
Universität Potsdam
Referat Presse- und Öffentlichkeitsarbeit
Am Neuen Palais 10
14469 Potsdam
Tel.: +49 331 977-1474
Fax: +49 331 977-1130
E-Mail: presse@uni-potsdam.de
Internet: www.uni-potsdam.de/presse
Wissenschaftliche Ansprechpartner:
Prof. Dr. Markus Gühr, markus.guehr@uni-potsdam.de
Originalpublikation:
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Größte bisher bekannte magnetische Anisotropie eines Moleküls gemessen
An der Berliner Synchrotronstrahlungsquelle BESSY II ist es gelungen, die größte magnetische Anisotropie eines einzelnen Moleküls zu bestimmen, die jemals experimentell gemessen wurde. Je größer diese Anisotropie ist, desto besser…

Tsunami-Frühwarnsystem im Indischen Ozean
20 Jahre nach der Tsunami-Katastrophe… Dank des unter Federführung des GFZ von 2005 bis 2008 entwickelten Frühwarnsystems GITEWS ist heute nicht nur der Indische Ozean besser auf solche Naturgefahren vorbereitet….

Resistente Bakterien in der Ostsee
Greifswalder Publikation in npj Clean Water. Ein Forschungsteam des Helmholtz-Instituts für One Health (HIOH) hat die Verbreitung und Eigenschaften von antibiotikaresistenten Bakterien in der Ostsee untersucht. Die Ergebnisse ihrer Arbeit…



