Das Weiss-Kruszka-Syndrom und das Scheitern der Zellidentität
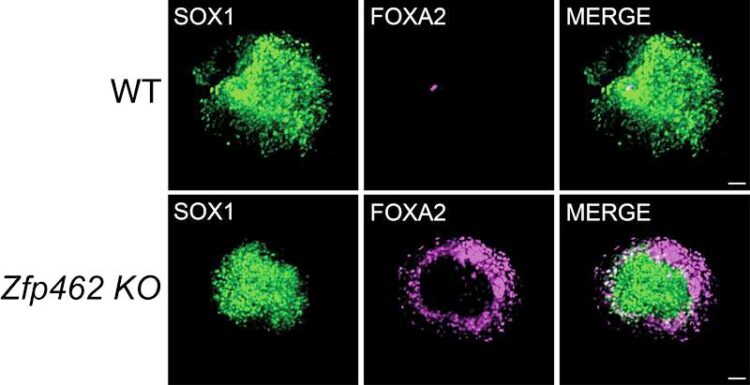
Die neuronale Spezifizierung ist in Zfp462-deletierten Zellen beeinträchtigt
© Bell-Forschungsgruppe / NCB / IMBA
Das Weiss-Kruszka-Syndrom ist eine seltene neurologische Entwicklungsstörung, die durch kraniofaziale Anomalien, Entwicklungsverzögerung und autistische Merkmale gekennzeichnet ist.
Forschende am Institut für Molekulare Biotechnologie (IMBA) der Österreichischen Akademie der Wissenschaften und der Keck School of Medicine der University of Southern California (USC) haben den molekularen Mechanismus des Weiss-Kruszka-Syndroms aufgedeckt: Die Mutation im Gen ZNF462 führt dazu, dass die Spezifikation der neuralen Abstammungslinie während der frühen Embryonalentwicklung nicht erhalten bleibt. Die Studie, die am Krankheitsmodell in Mauszellen durchgeführt wurde, erschien in Nature Cell Biology.
Mutationen in Genen, die für Heterochromatin-Regulatoren kodieren, stehen häufig in Zusammenhang mit neurologischen Entwicklungsstörungen. Es wird angenommen, dass Heterochromatin (dicht verpackte DNA) die Identität von Nervenzellen stabilisiert in dem es die transkriptionelle Repression von abstammungsunspezifischen Genen erzwingt. Die meisten Heterochromatin-Regulatoren werden jedoch in allen Zellarten exprimiert und haben keine Bindungsspezifizität für bestimmte DNA-Sequenzen. Daher ist nach wie vor unklar, wie diese Genrepression zielspezifisch gesteuert wird, und wie Mutationen in Heterochromatin-Regulatoren zu neuronalen Defekten beitragen.
Die ForscherInnen haben nun den molekularen Mechanismus aufgedeckt, der den Heterochromatin-Regulatoren-Komplex G9A/GLP an die DNA bindet, um abstammungsunspezifische Gene während der frühen Neurogenese zu unterdrücken. Sie fanden heraus, dass das bisher nicht charakterisierte Maus-Zinkfingerprotein ZFP462 direkt mit G9A/GLP interagiert. Auf diese Weise baut ZFP462 repressives Heterochromatin an Steuerelementen von Mesoderm- und Endoderm-spezifischen Genen in embryonalen Stammzellen und neuralen Vorläuferzellen der Maus auf. In mutierten Zfp462-Zellen führte die fehlende Repression von nicht-neuronalen Steuerelementen zu deren abweichender Expression. Dies wiederum führte zu einer Fehlspezifizierung neuronaler Zellen hin zu meso- und endodermalen Zell-Abstammungen. Beim Menschen verursacht eine Mutation in einem Allel des ZNF462-Gens, die menschliche Version des Maus-Gens Zfp462, eine seltene genetische Störung, die als Weiss-Kruszka-Syndrom bekannt ist. Das Weiss-Kruszka-Syndrom geht mit einem hohen Risiko für Autismus-Spektrum-Störungen einher. Auf Grundlage der Ergebnisse in Mäusezellen ist es wahrscheinlich, dass die Neuropathologie bei Personen, die unter dem Weiss-Kruszka-Syndrom leiden, durch Defekte in der neuronalen Zellspezifikation verursacht wird.
ZFP462 und Zellabstammungsspezifikationen im frühen Embryo
„Wir konnten zeigen, dass ZFP462 eine Schlüsselrolle bei der Sicherung der neuralen Abstammungsspezifikation in Zellen früher Mäuseembryonen spielt“, sagt der Erst- und mit-korrespondierende Autor Ramesh Yelagandula, der dieses Forschungsprojekt während seiner Postdoc-Zeit in der Forschungsgruppe des ehemaligen IMBA-Gruppenleiters Oliver Bell begonnen hat. In ihrer Studie zeigten Yelagandula, Bell und ihr Team, dass die durch ZFP462 vermittelte Rekrutierung von G9A/GLP die Bildung von Heterochromatin an nicht-neuralen Steuerelementen in die Wege leitet. Heterochromatin schränkt die Bindung aktivierender Transkriptionsfaktoren ein und verhindert die Expression von Genen, die an der Spezifikation für mesodermale und endodermale Zell-Abstammungen beteiligt sind. Daher ist ZFP462 für die Förderung der Ektoderm-Identität unerlässlich, damit sich neuronale Zellen richtig entwickeln können.
Wahrung der Identität neuronaler Zellen
„Die drei Zell-Abstammungen, die zu Ektoderm, Mesoderm und Endoderm führen, entstehen sehr früh während der Embryonalentwicklung“, sagt der letzte und mit-korrespondierende Autor Bell. Ektodermale Zellen differenzieren sich weiter zu neuronalen Zellen und Geweben wie Nerven, Gehirn und Rückenmark. „Sobald die verschiedenen Zell-Abstammungen festgelegt sind, ist die Aufrechterhaltung ihrer Identität entscheidend für die Funktion bestimmter Zellen und Gewebe“, sagt Yelagandula. Der Verlust der Zellidentität verursacht Entwicklungsstörungen und kann zu Krankheiten führen. Daher sind Heterochromatin-Regulatoren zur Aufrechterhaltung der Zellabstammungsspezifikation und der Zellidentität erforderlich.
Mögliche zukünftige Therapie?
ZNF462, das am Weiss-Kruszka-Syndrom beteiligte Gen, ist in Wirbeltieren hoch konserviert. Die Charakterisierung des Mechanismus des Maus-Orthologs Zfp462 wirft ein Licht auf den möglichen molekularen Mechanismus, der dieser seltenen menschlichen Neuroentwicklungsstörung zugrunde liegt. „Unsere Daten deuten darauf hin, dass das Weiss-Kruszka-Syndrom durch eine abweichende Aktivierung von zellabstammungsunspezifischen Genen in der neuronalen Linie während der frühen Embryogenese entstehen könnte“, sagt Bell.
Die ForscherInnen erwägen mögliche Anwendungen für die Behandlung betroffener PatientInnen. PatientInnen, bei denen das Weiss-Kruszka-Syndrom diagnostiziert wird, tragen nur ein mutiertes Allel von ZNF462, das ein frühes Stopcodon enthält, während das zweite Allel funktionsfähig ist. Da nur ein gesundes Allel vorhanden ist, ist die Menge des funktionellen Proteins reduziert. „Wir untersuchen derzeit die Möglichkeit ob die Expression eines verkürzten, möglicherweise fehlgefalteten Proteins vom mutierten Allel einen pathologischen Beitrag bei der Genregulation zur Folge hat. Sollte dies der Fall sein, könnten wir durch Neutralisierung des abgeschnittenen Proteins eingreifen und die Symptome der Patienten lindern“, berichtet Yelagandula.
Diese Studie, die in der Forschungsgruppe von Oliver Bell am IMBA, einem Forschungsinstitut des Vienna BioCenter (VBC), initiiert wurde, wird von Ramesh Yelagandula und Karin Stecher (einer PhD-Absolventin des VBC PhD Program) mitverfasst. Nach dem Umzug der Bell-Forschungsgruppe an die Keck School of Medicine der University of Southern California in Los Angeles im Jahr 2018 setzte Yelagandula seine Postdoc-Forschung am IMBA in der Forschungsgruppe von Julius Brennecke fort.
Originalveröffentlichung:
Yelagandula R., Stecher K, et al., „ZFP462 safeguards neural lineage specification by targeting G9A/GLP- mediated heterochromatin to silence enhancers“, Nature Cell Biology, 2023. DOI: 10.1038/s41556-022-01051-2
Über das IMBA:
Das IMBA – Institut für Molekulare Biotechnologie – ist eines der führenden biomedizinischen Forschungsinstitute in Europa. IMBA ist im Vienna BioCenter angesiedelt, dem pulsierenden Cluster von Universitäten, Forschungsinstituten und Biotech-Unternehmen in Österreich. IMBA ist eine Tochtergesellschaft der Österreichischen Akademie der Wissenschaften, dem führenden nationalen Förderer der außeruniversitären akademischen Forschung. Die Stammzell- und Organoidforschung am IMBA wird vorwiegend vom österreichischen Wissenschaftsministerium und der Stadt Wien finanziert.
Originalpublikation:
Yelagandula R., Stecher K, et al., „ZFP462 safeguards neural lineage specification by targeting G9A/GLP- mediated heterochromatin to silence enhancers“, Nature Cell Biology, 2023. DOI: 10.1038/s41556-022-01051-2
Weitere Informationen:
https://bit.ly/ZFP462_de (Link zum Pressemitteilungstext auf der IMBA-Webseite)
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Sensoren für „Ladezustand“ biologischer Zellen
Ein Team um den Pflanzenbiotechnologen Prof. Dr. Markus Schwarzländer von der Universität Münster und den Biochemiker Prof. Dr. Bruce Morgan von der Universität des Saarlandes hat Biosensoren entwickelt, mit denen…

Organoide, Innovation und Hoffnung
Transformation der Therapie von Bauchspeicheldrüsenkrebs. Bauchspeicheldrüsenkrebs (Pankreaskarzinom) bleibt eine der schwierigsten Krebsarten, die es zu behandeln gilt, was weltweite Bemühungen zur Erforschung neuer therapeutischer Ansätze anspornt. Eine solche bahnbrechende Initiative…

Leuchtende Zellkerne geben Schlüsselgene preis
Bonner Forscher zeigen, wie Gene, die für Krankheiten relevant sind, leichter identifiziert werden können. Die Identifizierung von Genen, die an der Entstehung von Krankheiten beteiligt sind, ist eine der großen…



