Fehlfaltung im Alzheimer-Gehirn
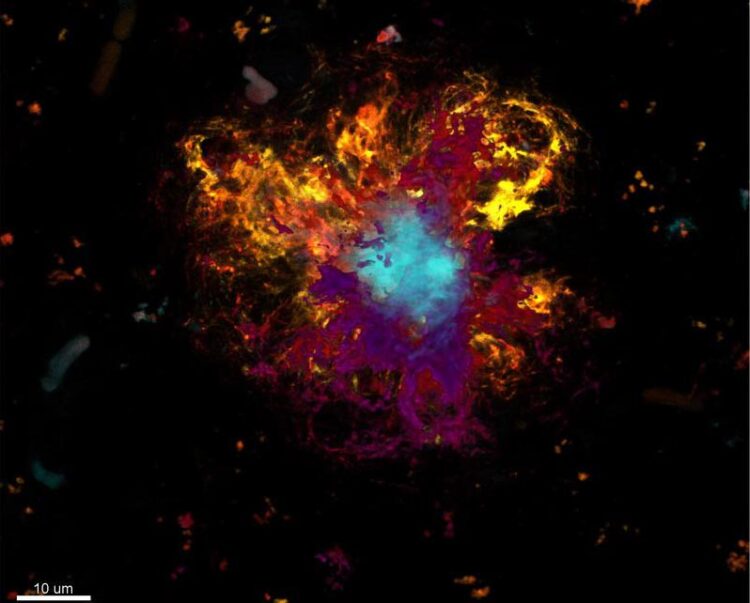
Plaques im Alzheimer-Gehirn
AG Wanker, ALM, MDC
Erich Wanker möchte herausfinden, inwieweit fehlgefaltete und damit krankhafte Amyloid-Eiweiße auch andere Proteine der Nervenzellen strukturell verändern – und so zum Fortschreiten der Alzheimer-Demenz beitragen. Dafür hat er von der privaten „Alzheimer Forschung Initiative“ 120.000 Euro erhalten.
Alzheimer entwickelt sich im Verborgenen. Bereits viele Jahre, bevor die ersten Zeichen der Erkrankung sichtbar werden, nimmt diese im Gehirn ihren unheilvollen Verlauf. Kleine Proteine, die Beta-Amyloid-Peptide, verändern aus noch unbekannten Gründen ihre räumliche Struktur. Dadurch werden sie klebrig und verklumpen zwischen den Nervenzellen zu Plaques. Das löst im Gehirn eine Entzündung aus, bei der sich Bündel ebenfalls fehlgefalteter Proteine, die Tau-Fibrillen, in den Zellen ansammeln. Irgendwann bedeuten die Fibrillen für die Zellen den sicheren Tod. Was genau diese tödliche Kaskade in Gang setzt, ist für die Wissenschaft aber noch immer ein großes Rätsel.
Krankhaft veränderte Eiweiße beeinflussen gesunde Proteine
„Erst seit einigen Jahren weiß man, dass fehlgefaltete Beta-Amyloide offenbar in der Lage sind, auch andere Proteine umzuformen – ähnlich wie man es bei den vom Rinderwahn bekannten Prionen beobachten kann“, sagt Professor Erich Wanker vom Berliner Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC). „Kommt ein fehlgefaltetes Peptid mit einem gesunden Peptid in Kontakt, beginnt Letzteres ebenfalls, seine räumliche Struktur zu verändern“, erklärt der Leiter der Arbeitsgruppe „Proteomforschung und molekulare Mechanismen bei neurodegenerativen Erkrankungen“. Auf diese Weise entstehen im Gehirn immer mehr der schädlichen Plaques. Auch beim Tau-Protein hat man solche Eigenschaften in Experimenten mit Mäusen bereits beobachtet. „Das bedeutet jedoch nicht, dass Alzheimer von Mensch zu Mensch weitergegeben werden kann“, betont Wanker. „Die Umfaltung erfolgt ausschließlich im Gehirn, von Protein zu Protein.“
Unklar ist bislang, ob die fehlgefalteten Amyloid- und Tau-Eiweiße ihre krankmachende Struktur nur untereinander übertragen können oder ob die Ausbreitung – das „Seeding“, wie Wanker es nennt – auch zwischen den beiden Proteinen erfolgen kann. Genau das möchte der MDC-Wissenschaftler jetzt gemeinsam mit seinem Team erforschen. Unterstützt wird er dabei in den kommenden drei Jahren, als einer von insgesamt elf prämierten Forscher*innen, von der gemeinnützigen Alzheimer Forschung Initiative e.V. (AFI). Sie stellt Wanker Fördermittel von insgesamt 120.000 Euro zur Verfügung. Die AFI ist der größte private Förderer der Alzheimer-Forschung an deutschen Universitäten und öffentlichen Einrichtungen. Seit dem Jahr 1995 sammelt der Verein private Spendengelder für sein wichtigstes Anliegen, Alzheimer eines Tages heilbar zu machen.
Ziel ist es, die Ausbreitung der Amyloide im Gehirn zu verhindern
„Ich freue mich sehr über diese Auszeichnung, mit deren Hilfe ich eine wissenschaftliche Mitarbeiterin beschäftigen möchte und darüber hinaus Labormaterialien wie Zellkulturen oder synthetisch hergestellte Amyloid- und Tau-Proteine finanzieren kann“, sagt Wanker. „Unser Ziel ist es, in den nächsten Jahren Ansätze für neue Medikamente zu entwickeln, die die Vermehrung und die Ausbreitung der fehlgefalteten Proteine im Gehirn unterbinden.“
Zunächst plant der Forscher dazu Experimente mit Nervenzellen in der Kulturschale. „Die Zellen sind genetisch so verändert, dass Ansammlungen fehlgefalteter Eiweiße sichtbar werden“, erläutert Wanker. „Wir werden diese Proteine in Zellen einschleusen und dann untersuchen, ob die entstehenden Aggregate tatsächlich von Zelle zu Zelle weitergebeben werden.“ Ganz ähnliche Experimente sind mit Fruchtfliegen, also im lebenden Organismus, geplant. „Keines der bisher getesteten Medikamente gegen die Alzheimer-Demenz hat sich gegen das Seeding gerichtet“, sagt Wanker. Und vielleicht ist das ja zumindest einer der Gründe, warum man bei der Behandlung der Krankheit bislang kaum Erfolge erzielt hat.
Das Max-Delbrück-Centrum für Molekulare Medizin (MDC)
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) wurde 1992 in Berlin gegründet. Es ist nach dem deutsch-amerikanischen Physiker Max Delbrück benannt, dem 1969 der Nobelpreis für Physiologie und Medizin verliehen wurde. Aufgabe des MDC ist die Erforschung molekularer Mechanismen, um die Ursachen von Krankheiten zu verstehen und sie besser zu diagnostizieren, verhüten und wirksam bekämpfen zu können. Dabei kooperiert das MDC mit der Charité – Universitätsmedizin Berlin und dem Berlin Institute of Health (BIH) sowie mit nationalen Partnern, z.B. dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DHZK), und zahlreichen internationalen Forschungseinrichtungen. Am MDC arbeiten mehr als 1.600 Beschäftigte und Gäste aus nahezu 60 Ländern; davon sind fast 1.300 in der Wissenschaft tätig. Es wird zu 90 Prozent vom Bundesministerium für Bildung und Forschung und zu 10 Prozent vom Land Berlin finanziert und ist Mitglied in der Helmholtz-Gemeinschaft deutscher Forschungszentren. www.mdc-berlin.de
Wissenschaftliche Ansprechpartner:
Professor Erich Wanker: ewanker@mdc-berlin.de
Weitere Informationen:
https://www.alzheimer-forschung.de/forschung/forschungsprojekte/projektdatenbank… – Projekt auf der Seite der Alzheimer Forschung Initiative
https://www.mdc-berlin.de/de/wanker – Arbeitsgruppe Wanker am MDC
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Sensoren für „Ladezustand“ biologischer Zellen
Ein Team um den Pflanzenbiotechnologen Prof. Dr. Markus Schwarzländer von der Universität Münster und den Biochemiker Prof. Dr. Bruce Morgan von der Universität des Saarlandes hat Biosensoren entwickelt, mit denen…

Organoide, Innovation und Hoffnung
Transformation der Therapie von Bauchspeicheldrüsenkrebs. Bauchspeicheldrüsenkrebs (Pankreaskarzinom) bleibt eine der schwierigsten Krebsarten, die es zu behandeln gilt, was weltweite Bemühungen zur Erforschung neuer therapeutischer Ansätze anspornt. Eine solche bahnbrechende Initiative…

Leuchtende Zellkerne geben Schlüsselgene preis
Bonner Forscher zeigen, wie Gene, die für Krankheiten relevant sind, leichter identifiziert werden können. Die Identifizierung von Genen, die an der Entstehung von Krankheiten beteiligt sind, ist eine der großen…



