In Zeitlupe gegen Antibiotikaresistenz
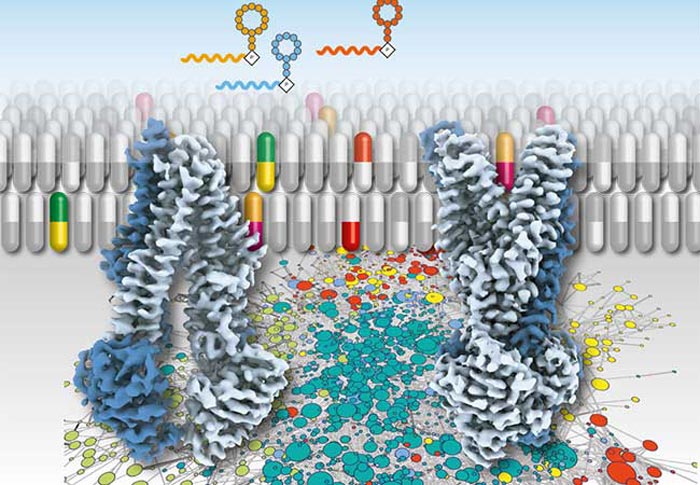
Synthetic therapeutics for antibiotic resistance in bacteria or multidrug resistance in tumour cells can block ATP-driven transport proteins that carries chemotherapeutics out of the cell. (Graphic: Robert Tampé, Institute for Biochemistry, Biocentre, Goethe University Frankfurt)
Wie neuartige Therapeutika Einblicke in Membrane von Bakterien geben…
Ob Bakterien gegen Antibiotika resistent sind, entscheidet sich oft an ihrer Zellmembran. Dort können Antibiotika auf dem Weg ins Zellinnere blockiert oder von innen nach außen katapultiert werden. Makrozyklische Peptide, eine neuartige Klasse von Antibiotika, bioaktiver Zellgifte und Hemmstoffe (Inhibitoren), geben Aufschluss darüber, wie dieser Transportprozess an der Membran verläuft, wie er beeinflusst wird und wie er genutzt werden kann, um die Resistenz einer bösartig transformierten Zelle zu umgehen. Die Forschungsergebnisse, die hierzu unter der Leitung von Prof. Dr. Robert Tampé (Goethe-Universität) und von Prof. Dr. Hiroaki Suga (Universität Tokyo) erarbeitet wurden, werden in dem renommierten Journal eLife veröffentlicht (20-02-2021-RA-eLife-67732).
Es gibt zurzeit nur wenige synthetische Wirkstoffe, die an die weit verbreiteten Membrantransportproteine, den ATP-Bindungskassettentransportern (ABC), binden und diese blockieren. Vier dieser makrozyklischen Peptide haben Wissenschaftler der Goethe-Universität und der Universität von Tokyo als Modelle für eine neuartige Generation von Wirkstoffen identifiziert. Dabei kamen Methoden zur Anwendung, für die die beteiligten Wissenschaftlerinnen und Wissenschaftler als weltweit führend gelten.
Dank Deep Sequencing, einem extrem schnellen und effizienten Ausleseverfahren, konnten die gewünschten makrozyklischen Peptide aus einer Billionen Varianten umfassenden “Bibliothek” makrozyklischer Peptide herausgefiltert werden – diese Zahl übersteigt die Anzahl an Sternen in der Milchstraße. Dass überhaupt eine solch enorme Anzahl vorliegt, hängt mit einem neuartigen Verfahren zusammen: Durch Reprogrammierung des genetischen Codes können Aminosäuren gezielt als Wirkstoffbauteile verwendet werden, die sonst in der Zelle nicht genutzt werden. Vor allem durch ihre kreisförmige, geschlossene Struktur unterscheiden sie sich von natürlichen Proteinen.
“Weil diese Therapeutika zyklisch sind, werden sie in der Zelle weniger schnell abgebaut”, erklärt Robert Tampé, Direktor des Instituts für Biochemie an der Goethe-Universität. “Außerdem sind die ringförmigen Wirkstoffe in ihrer Raumstruktur eingeschränkt, sie binden deshalb ohne große Umlagerungen an das Zielmolekül.”
Ein drittes Unterscheidungsmerkmal macht die makrozyklischen Peptide ganz besonders attraktiv für die Wissenschaftler:innen: Bei der Herstellung der Wirkstoffe wird ihre Bauanleitung als “Barcode” mitgeliefert. Sucht man in einer Anzahl von Billionen synthetisch erzeugter Therapeutika bestimmte heraus, führen sie ihr “Namensetikett” gleichsam mit sich.
Welche Rolle spielen nun die synthetischen Therapeutika für die Antibiotikaresistenz in Bakterien oder die Multidrogenresistenz von Tumorzellen? Was geschieht, wenn sie auf das ATP-getriebene Transportmolekül treffen, das für die Resistenz verantwortlich ist, indem es die Chemotherapeutika aus der Zelle befördert? Kurz zusammengefasst: Die Wirkstoffe blockieren den Transporter, indem sie an ihn binden. Dies kann am Anfang oder am Ende eines Transportprozesses geschehen, wenn sich der Transporter im Ruhzustand befindet. Da die Wissenschaftler:innen den Transportprozess aber verlangsamen können, so dass er wie in Zeitlupe abläuft, können die Wirkstoffe identifiziert werden, die mitten im Transportprozess “einsteigen” und das Membranprotein in seiner jeweiligen Position “festhalten“. So erhalten die Forscher:innen einen Einblick in die Choreographie des Transportprozesses wie durch die Bilder eines Filmstreifens.
Diese Einblicke haben in der Wissenschaft bereits zu einem “Paradigmenwechsel” geführt, wie Tampé erklärt: „Bislang sind wir davon ausgegangen, dass die ATP-Hydrolyse (Anm: ein Energie freisetzender Spaltprozess) die Energie für den Transport durch die Membran liefert. Dies ist aber nur indirekt der Fall. Es ist das Ereignis der Bindung des ATP-Moleküls, das Substanzen aus der Zelle stößt. Die Energie der Hydrolyse wird dagegen dafür eingesetzt, den ABC-Transporter wieder in seinen Ausgangszustand zu versetzen.” Diese und andere Einblicke in das Membrangeschehen, so die Überzeugung der Arbeitsgruppen an der Goethe-Universität und der Universität Tokyo, zeigen Wege auf, wie zukünftige Arzneimittel entwickelt werden können.
Die Grundlagenforschung zu zellulären Membranen und Membranproteinen hat in Frankfurt bereits eine lange Tradition. Robert Tampé klärte wesentliche Mechanismen von ATP-getriebenen Transportproteinen und zellulären Maschinerien der adaptiven Immunantwort und Qualitätskontrolle, die gemeinsam mit der neuen Publikation Ansätze für die angewandte Arzneimittelforschung liefern können. Nachdem Tampé Sprecher des Ende 2020 ausgelaufenen Sonderforschungsbereichs »Transport und Kommunikation über biologische Membranen« (SFB 807) war, befindet sich das Konzept für ein neues Forschungszentrum bereits in der Entwicklung. Dabei sollen hochdynamische Prozesse in Bezug auf Proteinnetzwerke und Maschinerien in zellulären Membranen erforscht werden. Langfristig sollen die Forschungsergebnisse neue Möglichkeiten für die Therapie von molekularen Krankheiten, Infektionen und Krebs aufzeigen.
Wissenschaftliche Ansprechpartner:
Prof. Dr. Robert Tampé
Institut für Biochemie, Biozentrum
Goethe-Universität Frankfurt
tampe@em.uni-frankfurt.de
Prof. Dr. Hiroaki Suga
Department of Chemistry
Graduate School of Science
The University of Tokyo
hsuga@chem.s.u-tokyo.ac.jp
Originalpublikation:
Erich Stefan, Richard Obexer, Susanne Hofmann, Khanh Vu Huu, Yichao Huang und Nina Morgner, zudem federführend Hiroaki Suga und Robert Tampé: „De novo macrocyclic peptides dissect energy coupling of a heterodimeric ABC transporter by multimode allosteric inhibition“ (20-02-2021-RA-eLife-67732)
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Größte bisher bekannte magnetische Anisotropie eines Moleküls gemessen
An der Berliner Synchrotronstrahlungsquelle BESSY II ist es gelungen, die größte magnetische Anisotropie eines einzelnen Moleküls zu bestimmen, die jemals experimentell gemessen wurde. Je größer diese Anisotropie ist, desto besser…

Tsunami-Frühwarnsystem im Indischen Ozean
20 Jahre nach der Tsunami-Katastrophe… Dank des unter Federführung des GFZ von 2005 bis 2008 entwickelten Frühwarnsystems GITEWS ist heute nicht nur der Indische Ozean besser auf solche Naturgefahren vorbereitet….

Resistente Bakterien in der Ostsee
Greifswalder Publikation in npj Clean Water. Ein Forschungsteam des Helmholtz-Instituts für One Health (HIOH) hat die Verbreitung und Eigenschaften von antibiotikaresistenten Bakterien in der Ostsee untersucht. Die Ergebnisse ihrer Arbeit…



