Kryoelektronenmikroskopie: Hochauflösende Bilder mit günstiger Technik
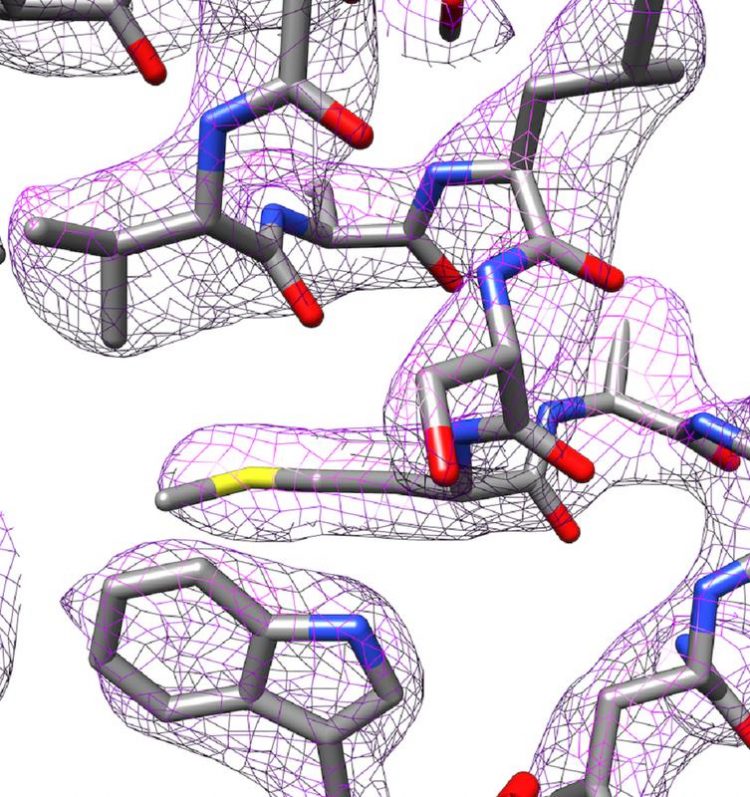
Teil der 3D-Struktur von Apoferritin Panagiotis Kastritis
Kryoelektronenmikroskopie hat in den vergangenen Jahren entscheidend an Bedeutung gewonnen, besonders um die Struktur von Proteinen aufzuklären. Die Entwickler der neuen Technik erhielten 2017 den Nobelpreis für Chemie.
Der Trick: Die Proben werden schockgefroren und dann mit Elektronen beschossen. In der klassischen Elektronenmikroskopie hingegen wird der Probe zuvor jegliches Wasser entzogen. Das ist nötig, weil die Untersuchung im Vakuum stattfindet, wobei Wasser sofort verdunsten und damit eine Aufnahme unmöglich machen würde.
Wassermoleküle spielen jedoch in Biomolekülen, insbesondere in Proteinen, eine so wichtige Rolle, dass sie sich mit der klassischen Elektronenmikroskopie nicht untersuchen lassen.
Proteine gehören zu den wichtigsten Bausteinen von Zellen und übernehmen eine Vielzahl an Aufgaben. Detaillierte Kenntnisse ihrer Struktur sind nötig, um ihre Funktionsweise zu verstehen.
In der Arbeitsgruppe von Dr. Panagiotis Kastritis, Gruppenleiter im Zentrum für Innovationskompetenz HALOmem und Juniorprofessor am Institut für Biochemie und Biotechnologie der MLU, wurde 2019 ein modernes Kryoelektronenmikroskop installiert.
„Ein derartiges Mikroskop gab es in Halle vorher nicht“, so Kastritis. Das neue „Thermo Fisher Glacios 200 kV“, welches vom Bundesministerium für Bildung und Forschung finanziert wurde, ist zwar nicht das Beste und Teuerste seiner Art. Dennoch gelang es damit Kastritis und seinen Mitarbeitern, die Struktur des Eisenspeicherproteins Apoferritin bis auf 2,7 Ångström (Å) genau aufzuklären, also beinahe bis aufs einzelne Atom.
Ein Ångström entspricht einem zehntel Nanometer. Damit spielen sie in einer ähnlichen Liga wie Abteilungen mit weit teureren Geräten. Apoferritin wird häufig als Referenzprotein zur Bestimmung der Leistungsstärke entsprechender Mikroskope verwendet. Gerade erst berichteten zwei Arbeitsgruppen mit einer Auflösung von etwa 1,2 Å einen neuen Rekord.
„Solche Werte können nur mit sehr leistungsstarken Geräten erzielt werden, die weltweit nur wenige Arbeitsgruppen besitzen. Unsere neue Methode ist für die Mikroskope gedacht, die es in vielen Laboren gibt“, erklärt Kastritis.
Kryoelektronenmikroskope sind sehr komplexe Geräte. „Schon winzige Fehleinstellungen können die Bilder unbrauchbar machen“, so Kastritis. Es komme darauf an, sie richtig zu programmieren und dafür gebe es in Halle die fachliche Expertise. Mindestens ebenso wichtig ist jedoch die anschließende Auswertung der erhobenen Daten.
„Das Mikroskop produziert mehrere tausend Bilder“, erklärt Kastritis. Mithilfe von Bildverarbeitungsprogrammen wird daraus eine 3D-Struktur des Moleküls rekonstruiert. In Kooperation mit Prof. Dr. Milton T. Stubbs vom Institut für Biochemie und Biotechnologie der MLU haben die Forscher eine neue Methode entwickelt, um ein hochauflösendes Proteinmodell erstellen zu können.
Stubbs' Arbeitsgruppe nutzt Röntgenkristallographie, eine andere Technik zur Aufklärung der Struktur von Proteinen, bei der diese jedoch kristallisiert werden müssen. Die Bildanalysetechnik ließ sich, in abgewandelter Form, auch mit den Aufnahmen aus dem Kryoelektronenmikroskop kombinieren. So können auch Ladungszustände und einzelne Wassermoleküle sichtbar gemacht werden.
„Das ist eine attraktive Technik“, so Kastritis. Statt sehr teurer Mikroskope wird eine Menge Rechenkapazität benötigt, welche an der MLU vorhanden ist. Die Kryoelektronenmikroskopie erlaubt es nun, Proteine komplementär zur Röntgenkristallographie abzubilden – insbesondere solche, die sich nur schwer kristallisieren lassen. Das ermöglicht Kooperationen innerhalb und außerhalb der Universität zur Strukturanalyse von Proben mit medizinischem und biotechnologischem Potenzial.
Jun.-Prof. Dr. Panagiotis Kastritis
Institut für Biochemie und Biotechnologie der MLU
Zentrum für Innovationskompetenz HALOmen „Struktur und Dynamik von Membranproteinen“
Telefon: +49 345 55-24983
E-Mail: panagiotis.kastritis@bct.uni-halle.de
Web: https://blogs.urz.uni-halle.de/kastritislab/
Hamdi, Farzad et al. 2.7 Å cryo-EM structure of vitrified M. musculus H-chain apoferritin from a compact 200 keV cryo-microscope. PLOS ONE (2020). https://doi.org/10.1371/journal.pone.0232540
Media Contact
Weitere Informationen:
http://www.uni-halle.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Ein endloser Kreislauf: Wie sich einige Bakterien mit den Jahreszeiten entwickeln
Die längste jemals gesammelte natürliche Metagenom-Zeitreihe mit Mikroben offenbart ein verblüffendes evolutionäres Muster, das sich wiederholt. Ein mikrobielles „Murmeltiertagsjahr“ im Lake Mendota Ähnlich wie Bill Murray im Film „Und täglich…

Entdecken Sie bahnbrechende Forschung zur Regeneration der Achillessehne
Achillessehnenverletzungen sind häufig, aber aufgrund der Einschränkungen aktueller Bildgebungstechniken schwer während der Genesung zu überwachen. Forschende unter der Leitung von Associate Professor Zeng Nan von der International Graduate School in…

Warum Prävention besser ist als Heilung – Ein neuartiger Ansatz für den Umgang mit Infektionskrankheiten
Forscher haben eine neue Methode entwickelt, um ansteckendere Varianten von Viren oder Bakterien zu identifizieren, die sich unter Menschen auszubreiten beginnen – darunter Erreger von Grippe, COVID, Keuchhusten und Tuberkulose….



