Maximale Präzision bei der Herstellung von Proteinen
Quelle: http://www.uni-heidelberg.de/presse/news2017/pm20170908_maximale-praezision-bei-der-herstellung-von-proteinen.html
Die Wirkungsweise eines wichtigen Chaperons – eines molekularen Helfers bei der Herstellung von Proteinen – haben Wissenschaftler des Zentrums für Molekulare Biologie der Universität Heidelberg (ZMBH) und des Deutschen Krebsforschungszentrums (DKFZ) untersucht.
Gemeinsam mit Kollegen der Universität zu Köln und der Penn State University (USA) konnten sie zeigen, dass die Geschwindigkeit der Proteinherstellung und die Funktion dieses Chaperons mit der Bezeichnung Ssb zusammenhängen. Die Information zur Kontrolle der Synthesegeschwindigkeit ist im genetischen Code der Zelle gespeichert. So kann eine maximale Effizienz und Präzision in der Herstellung funktionsfähiger Proteine sicherstellt werden. Die Forschungsergebnisse wurden in „Cell“ veröffentlicht.
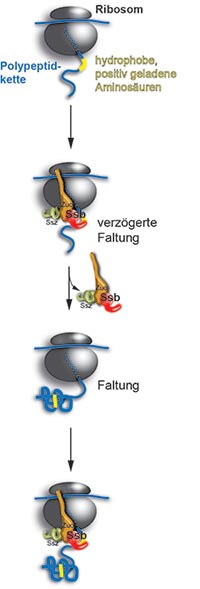
Jede Zelle enthält Tausende verschiedener Proteine, die jeweils eine genau bestimmte Funktion im Organismus übernehmen. Die Baupläne zu ihrer Herstellung sind in den Genen gespeichert. Große molekulare Maschinen der Zelle – die Ribosomen – lesen die Information und nutzen sie zur Herstellung langer Ketten von Aminosäuren.
Diese sogenannten Polypeptide müssen anschließend in dreidimensionale Strukturen „falten“, damit ein funktionsfähiges Protein entsteht. Der lebensnotwendige Prozess der Proteinsynthese ist hochkomplex und anfällig für Fehler. Er wird deshalb durch molekulare Faltungshelfer, den Chaperonen, abgesichert und dirigiert.
Einige Chaperone binden direkt an Ribosomen, um die entstehenden Polypeptide schon während ihrer Synthese bei der Faltung zu unterstützen. Wie diese Ribosom-assoziierten Chaperone die wachsenden Proteine erkennen und ihnen beim Faltungsprozess assistieren, war bislang unbekannt, ebenso welche Proteine überhaupt mit dem Chaperon in Kontakt kommen und ob die Geschwindigkeit der Proteinsynthese an die Funktion der Faltungshelfer angepasst ist.
Das deutsch-amerikanische Forscherteam um die ZMBH- und DKFZ-Wissenschaftler Prof. Dr. Bernd Bukau und Dr. Günter Kramer ist diesen Fragen nachgegangen, indem sie die Hsp70-Hitzeschockproteine der Hefe als Modell genutzt haben. Im Mittelpunkt stand das Chaperon Ssb, das als einziges Mitglied der weitverbreiteten Hsp-Familie direkten Kontakt mit dem Ribosom hat und schon zu einem sehr frühen Zeitpunkt in der Proteinherstellung aktiv ist. Mit ihren Untersuchungen konnten die Wissenschaftler fundamental neue Erkenntnisse über die Faltung neu synthetisierter Proteine gewinnen.
Das Ribosom-assoziierte Hsp70-Chaperon Ssb bindet an rund 70 Prozent der neu entstehenden zellulären Proteine. Darunter sind auch viele Proteine, die erst in einen anderen Bereich der Zelle transportiert werden müssen, bevor sie falten. Damit besitzt Ssb neben der Funktion als Faltungshelfer auch eine unerwartete zusätzliche Rolle beim zellulären Proteintransport.
Das Chaperon erkennt „sein“ wachsendes Proteinsubstrat, indem es einen Sequenzbereich bindet, der mit positiv geladenen und unpolaren Aminosäuren angereichert ist. Diese „Erkennungsmotive“ werden gebunden, sobald sie nach der Synthese an der Oberfläche des Ribosoms erscheinen. Dadurch verzögert Ssb den Faltungsvorgang, bis die Polypeptide lang genug sind, um in korrekter Weise falten zu können.
Unerwartet war für die Forscher die Entdeckung, dass die Ribosomen die Geschwindigkeit bei der Proteinherstellung dann erhöhen, wenn das Hsp70-Chaperon Ssb die entstehenden Polypeptide bindet und dadurch schützt. Sie konnten zeigen, dass die Information zur Anpassung der Synthesegeschwindigkeit an die Funktion molekularer Chaperone im genetischen Code gespeichert ist und nicht durch das Chaperon selbst kontrolliert wird.
OriginalpublikationK. Döring, N. Ahmed, T. Riemer, H.G. Suresh, Y. Vainshtein, M. Habich, J. Riemer, M.P. Mayer, E.P. O’Brien, G. Kramer, B. Bukau: Profiling Ssb-Nascent Chain Interactions Reveals Principles of Hsp70-Assisted Folding. Cell 170, 298-311, doi: 10.1016/j.cell.2017.06.038
Kontakt:
Prof. Dr. Bernd Bukau
Zentrum für Molekulare Biologie der Universität Heidelberg
Deutsches Krebsforschungszentrum
Tel. +49 6221 54-6795
bukau@zmbh.uni-heidelberg.de
Kommunikation und Marketing
Pressestelle
Tel. +49 6221 54-2311
presse@rektorat.uni-heidelberg.de
Media Contact
Weitere Informationen:
http://www.uni-heidelberg.deAlle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Sensoren für „Ladezustand“ biologischer Zellen
Ein Team um den Pflanzenbiotechnologen Prof. Dr. Markus Schwarzländer von der Universität Münster und den Biochemiker Prof. Dr. Bruce Morgan von der Universität des Saarlandes hat Biosensoren entwickelt, mit denen…

Organoide, Innovation und Hoffnung
Transformation der Therapie von Bauchspeicheldrüsenkrebs. Bauchspeicheldrüsenkrebs (Pankreaskarzinom) bleibt eine der schwierigsten Krebsarten, die es zu behandeln gilt, was weltweite Bemühungen zur Erforschung neuer therapeutischer Ansätze anspornt. Eine solche bahnbrechende Initiative…

Leuchtende Zellkerne geben Schlüsselgene preis
Bonner Forscher zeigen, wie Gene, die für Krankheiten relevant sind, leichter identifiziert werden können. Die Identifizierung von Genen, die an der Entstehung von Krankheiten beteiligt sind, ist eine der großen…



