Meiose: Mut zur Lücke!
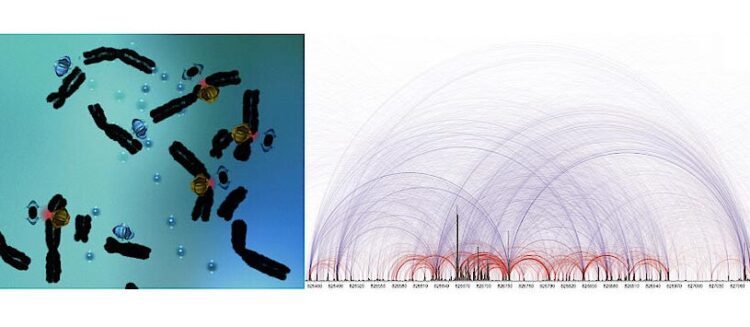
Scientists have now discovered that cells sometimes liberate DNA fragments at sites of paired, or double, DSBs
© Franz Klein, Chromosomenbiologie, Universität Wien
Ohne Meiose gibt es keine Geschlechtszellen für die sexuelle Fortpflanzung.
Während der Meiose paaren sich väterliche und mütterliche Chromosomen und tauschen Teile ihrer DNA in einem Prozess namens Rekombination aus. Um den Austausch zu beginnen, zerbrechen die Zellen aktiv den Doppelstrang ihrer DNA an mehreren Stellen.
Wissenschafter*innen aus der Forschungsgruppe von Franz Klein der Abteilung für Chromosomenbiologie an den Max Perutz Labs, ein Joint Venture der Universität Wien und der Medizinischen Universität Wien, haben nun entdeckt, dass Chromosomen dabei ganze DNA-Stücke freisetzen können.
Dies geschieht durch jeweils zwei benachbarte Doppelstrangbrüche, wodurch Lücken im Chromosom entstehen. Obwohl die entstehenden Lücken das Risiko von Mutationen bergen, könnten sie auch eine bisher unbekannte Quelle evolutionärer Diversität sein. Die Studie erscheint als „research article“ in Nature.
Im Menschen ist die genetische Information in insgesamt 46 Chromosomen kodiert. Körperzellen sind diploid, das heißt jedes der 23 unterschiedlichen Chromosomen existiert in zwei Varianten, den sogenannten Homologen. 23 Homologe stammen vom Vater, 23 von der Mutter. Geschlechtszellen wiederum sind haploid, sie haben nur die halbe Anzahl an Chromosomen. Sobald sie bei der Befruchtung verschmelzen, entsteht wieder ein Organismus mit diploi-dem Chromosomensatz. Die zufällige Durchmischung elterlicher Chromoso-men und der Austausch von DNA zwischen den Homologen (durch „Rekombination“) während der Reduktion des Erbguts auf die Hälfte bewirken die genetische Vielfalt unserer Nachkommen.
Meiose beginnt mit kontrollierter Selbstverletzung
Jede menschliche Geschlechtszelle enthält eine von Milliarden möglicher Kombinationen der vererbten elterlichen Genvarianten. Alle Organismen, die sich sexuell fortpflanzen, gehen ein hohes Risiko ein, um diese Vielfalt zu erreichen. Um die meiotische Rekombination einzuleiten, brechen Zellen die DNA der Chromosomen an hunderten Stellen mit Hilfe des Spo11-Proteinkomplexes. Die Reparatur dieser Schäden ergibt die Gelegenheit, die Homologen zu verbinden und Stücke auszutauschen. „Zellen versuchen, Doppelstrangbrüche weit voneinander entfernt zu halten“, erklärt Gruppenleiter Franz Klein, „daher waren wir völlig überrascht, als wir entdeckten, dass etwa 20% aller Doppelstrangbrüchen nahe beieinander sind und paarweise auftreten, wodurch DNA-Stücke aus den Chromosomen gestanzt werden. Die entstehenden Lücken können – so wie die Brüche – Rekombination initiieren.“
Spo11 reagiert auf physikalischen Stress der DNA
Angeführt von der Molekularbiologin Silvia Prieler und der Bioinformatikerin Doris Chen wurden diese neu entdeckten Chromosomenstücke von Hefezellen isoliert und auf das Nukleotid genau vermessen, genauer als dies zuvor möglich war. Dadurch wurden Muster an den Bruchstellen sichtbar, die zeigen, dass die DNA beim Brechen stark gebogen werden muss. Das Team fand auch heraus, dass DNA an Stellen, an denen mehr topologischer Stress auftritt, häufiger gebrochen wird. Während der Transkription müssen die DNA-Doppelstränge getrennt werden, um die Produktion von RNA zu ermöglichen. Vor und hinter der Transkription entstehen dadurch Verdrillungen, die die DNA unter topologischen Stress setzen. Diese werden von den stresslösenden Topoisomerasen beseitigt, mit denen Spo11 verwandt ist. Warum also macht Spo11 Brüche, obwohl die Zelle genügend Nukleasen hätte, deren Hauptaufgabe es wäre, DNA zu schneiden? „Ein Ziel in der Meiose ist es, genetische Kombinationen an möglichst vielen, geeigneten Stellen zu erlauben“, sagt Franz Klein. „Spo11 ist dafür sehr gut geeignet; anstatt eine bestimmte DNA-Sequenz zu erkennen, wie das Nukleasen tun, wodurch Chromosomen immer an denselben Stellen rekombinieren würden, erkennt es den Stress der DNA und bringt damit die Rekombination zu häufig genutzten, aktiven Stellen des Chromosoms.“
Hohes Risiko – hohes Potential
Warum Zellen das Risiko eingehen, ihre Chromosomen zu durchlöchern, ist nicht völlig klar. Die Lücken im Chromosom bergen das Risiko, dort tatsächlich Information zu verlieren, oder sogar Fragmente von anderen Stellen zu integrieren. Die Wissenschafter*innen zeigen, dass die paarweisen Doppelstrangbrüche oft Promotoren treffen. Diese Abschnitte regulieren die Transkription von unmittelbar anschließenden Genen. „Über evolutionäre Zeiträume hinweg wäre es für Organismen praktisch, Steuerungselemente zwischen verschiedenen Genom-Orten austauschen zu können, was uns zu einer neuen Hypothese führt: Diese gepaarten Doppelstrangbrüche könnten die Evolution von Steuerungselementen im Genom deutlich beschleunigen“, so Franz Klein. Eine riskante Angelegenheit für die einzelnen Zellen, für die Spezies allerdings allemal das Risiko wert.
Über die Max Perutz Labs
Die Max Perutz Labs sind ein Joint Venture der Universität Wien und der Medizini-schen Universität Wien. Das Institut betreibt herausragende, international aner-kannte Forschung und Lehre auf dem Gebiet der Molekularbiologie. Wissenschaft-lerInnen der Max Perutz Labs erforschen grundlegende, mechanistische Prozesse in der Biomedizin und verbinden innovative Grundlagenforschung mit medizinisch relevanten Fragestellungen.
Die Max Perutz Labs sind Teil des Vienna BioCenter, einem führenden Hotspot der Lebenswissenschaften in Europa. Am Institut sind rund 50 Forschungsgrup-pen mit mehr als 450 MitarbeiterInnen aus 40 Nationen tätig.
www.maxperutzlabs.ac.at
Publikation in Nature:
Silvia Prieler, Doris Chen, Lingzhi Huang, Elisa Mayrhofer, Soma Zsótér, Magdalena, Vesely, Jean Mbogning, Franz Klein: Spo11 generates chromosomal gaps through 1 concerted cuts at sites of topological stress. Nature 2021. DOI: 10.1038/s41586-021-03632-x
Wissenschaftliche Ansprechpartner:
Ao. Univ.-Prof. Dr. Franz Klein
Max F. Perutz Laboratories
Universität Wien
1030 – Wien, Dr. Bohr-Gasse 9
+43-1-4277-562 20
franz.klein@univie.ac.at
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Du bist, was du isst – Stanford-Studie verbindet Ballaststoffe mit Modulation von Anti-Krebs-Genen
Die Ballaststofflücke: Ein wachsendes Problem in der amerikanischen Ernährung Ballaststoffe sind bekanntlich ein wichtiger Bestandteil einer gesunden Ernährung, doch weniger als 10 % der Amerikaner konsumieren die empfohlene Mindestmenge. Eine…

Vertrauen Sie Ihrem Bauchgefühl – RNA-Protein-Entdeckung für eine bessere Immunität
HIRI-Forscher entschlüsseln Kontrollmechanismen der Polysaccharidverwertung in Bacteroides thetaiotaomicron. Forschende des Helmholtz-Instituts für RNA-basierte Infektionsforschung (HIRI) und der Julius-Maximilians-Universität (JMU) Würzburg haben ein Protein sowie eine Gruppe kleiner Ribonukleinsäuren (sRNAs) in…

ASXL1-Mutation: Der verborgene Auslöser hinter Blutkrebs und Entzündungen
Wissenschaftler zeigen, wie ein mutiertes Gen rote und weiße Blutkörperchen schädigt. LA JOLLA, CA – Wissenschaftler am La Jolla Institute for Immunology (LJI) haben herausgefunden, wie ein mutiertes Gen eine…



