Nasenimpfstoff gegen Corona erfolgreich getestet
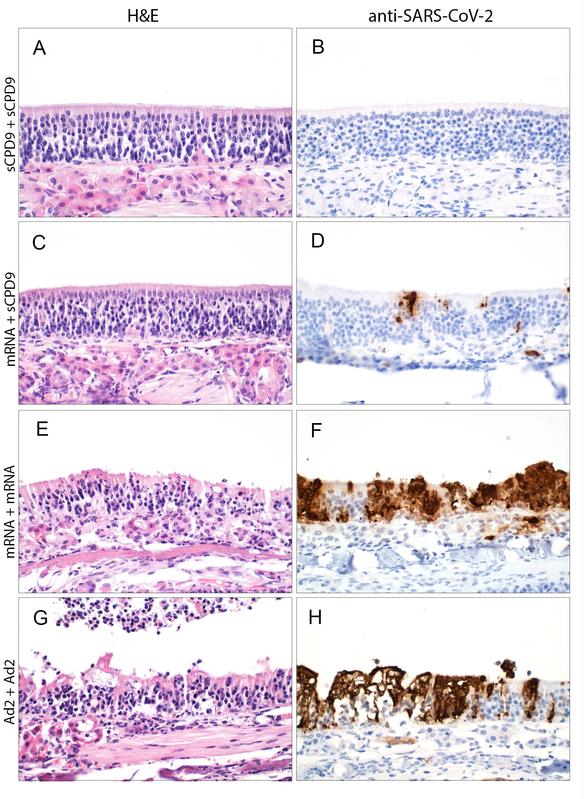
Nach zweifacher Impfung mit dem Lebendimpfstoff (A) verändert SARS-CoV-2 die Nasenschleimhaut der Hamster kaum (B). Die Kombination aus Lebend- und mRNA-Impfstoff (C) ist auch sehr effektiv; kleine Angriffsflächen (braun) findet das Virus aber (D).
(c) Anne Voß, Institut für Tierpathologie, Freie Universität Berlin
Seit Beginn der Corona-Pandemie arbeiten Forschende an Schleimhautimpfstoffen, die über die Nase verabreicht werden. Nun haben Berliner Wissenschaftler*innen eine abgeschwächte Lebendimpfung für die Nase entwickelt. In „Nature Microbiology“ beschreiben sie den besonderen Immunschutz, den sie auslöst.
Gemeinsame Pressemitteilung von Freier Universität Berlin, Max Delbrück Center und Charité – Universitätsmedizin Berlin
Coronaviren verbreiten sich vor allem durch die Luft. Wenn eine infizierte Person spricht, hustet, niest oder lacht, scheidet sie mit ihrer Atemluft Tröpfchen mit Viren aus. So können die Erreger in die Atemwege anderer Menschen gelangen und sie anstecken. Ein Berliner Forschungsteam will das Virus genau dort bekämpfen, wo es zuerst angreift: an den Schleimhäuten von Nase, Mund, Rachen und Lunge. Zu diesem Zweck haben die Wissenschaftler*innen einen nasal zu verabreichenden, abgeschwächten Lebendimpfstoff gegen SARS-CoV-2 entwickelt. In der aktuellen Ausgabe des Fachjournals „Nature Microbiology“ beschreibt das interdisziplinäre Team, wie dieser abgeschwächte Lebendimpfstoff eine bessere Immunität vermittelt als Impfstoffe, die in den Muskel gespritzt werden.
Bereits im Herbst vergangenen Jahres wurden zwei Präparate zur Impfung über die Nase in Indien und China zugelassen. Sie beruhen auf abgeschwächten Adenoviren, also Viren, die unter anderem Atemwegs- oder Magen-Darm-Erkrankungen auslösen, sich selbst aber nicht mehr oder nur noch schlecht vermehren und somit keine Krankheit verursachen. Weitere nasale Lebendimpfstoffe befinden sich weltweit in der Entwicklung und Erprobung.
Schützt dort, wo der Infekt beginnt
Die Vorteile eines Impfstoffs in Form eines Nasensprays gehen weit darüber hinaus, dass Menschen mit Angst vor einer Spritze aufatmen können. Wird ein Impfstoff gespritzt, baut sich die Immunität vor allem im Blut und über den ganzen Körper verteilt auf. Das bedeutet aber, dass das Immunsystem Coronaviren im Ernstfall erst verhältnismäßig spät entdeckt und bekämpft – denn diese dringen über die Schleimhäute der oberen Atemwege in den Körper ein. „Genau dort benötigen wir eine lokale Immunität, wenn wir ein Atemwegsvirus frühzeitig abfangen wollen“, sagt Co-Letztautor der Studie Dr. Jakob Trimpert, Tiermediziner und Arbeitsgruppenleiter am Institut für Virologie der Freien Universität Berlin.
„Nasale Impfstoffe bekommen das wesentlich besser hin als Vakzine, die injiziert werden und die Schleimhäute nur schwer oder gar nicht erreichen“, betont Dr. Emanuel Wyler, ebenfalls Co-Letztautor. Er erforscht das Coronavirus seit Ausbruch der Pandemie in der Arbeitsgruppe „RNA-Biologie und Posttranscriptionale Regulation“ unter der Leitung von Professor Markus Landthaler am Berliner Institut für Medizinische Systembiologie des Max Delbrück Center (MDC-BIMSB).
Im Idealfall regt ein nasaler Lebendimpfstoff direkt vor Ort die Bildung von Antikörpern, Immunglobulinen A (IgA), an und lässt damit eine Infektion gar nicht erst zu. IgA ist das am häufigsten vorkommende Immunglobulin in den Schleimhäuten der Atemwege. Es besitzt die Fähigkeit, Krankheitserreger zu neutralisieren, indem es sich an sie bindet und sie so daran hindert, Atemwegszellen zu infizieren. Gleichzeitig stimuliert die Impfung auch systemische Immunreaktionen, was insgesamt zu einem wirksamen Schutz vor einer Infektion beiträgt.
„Ähnlich wie Antikörper in der Schleimhaut, so sind auch im Lungengewebe ansässige T-Gedächtniszellen von Nutzen. Diese weißen Blutkörperchen können sich an Krankheitserreger erinnern und verbleiben nach einer Infektion im jeweiligen Gewebe. Ihre Positionierung in der Lunge ermöglicht es ihnen, schnell auf Krankheitserreger zu reagieren, die über die Atemwege eindringen“, sagt Dr. Geraldine Nouailles, Immunologin und Arbeitsgruppenleiterin an der Klinik für Pneumologie, Beatmungsmedizin und Intensivmedizin der Charité. Die Co-Erstautorin verweist auf eine Beobachtung, die das Team im Rahmen der Studie machen konnte: „Wir konnten nachweisen, dass es bei vorangegangener intranasaler Impfung auch zu einer verstärkten Reaktivierung dieser lokalen Gedächtniszellen im Falle einer SARS-CoV-2-Infektion kommt. Darüber haben wir uns natürlich besonders gefreut.“
Lokale Immunität verhindert Virusbefall
Die Wirkung des neu entwickelten nasalen COVID-19-Impfstoffs testeten die Wissenschaftler*innen an Hamstermodellen, die Trimpert und sein Team bereits zu Beginn der Pandemie an der Freien Universität Berlin etabliert haben. Die Tiere sind derzeit der wichtigste nicht transgene Modellorganismus für COVID-19, da sie sich mit denselben Virusvarianten wie Menschen infizieren lassen und ähnliche Krankheitssymptome entwickeln. Nach einer zweimaligen Gabe des Impfstoffes konnte sich das Virus im Modellorganismus nicht mehr vermehren. „Das Immungedächtnis wurde sehr gut angeregt, und die Schleimhäute waren aufgrund der hohen Antikörperkonzentration sehr gut geschützt“, erklärt Jakob Trimpert. Auch die Übertragbarkeit des Virus könnte auf diese Weise deutlich reduziert werden.
Darüber hinaus verglichen die Wissenschaftler*innen die Wirksamkeit des abgeschwächten Lebendimpfstoffes mit der von intramuskulär injizierten Impfstoffen. Dafür impften sie die Hamster entweder zweimal mit dem Lebendimpfstoff, einmal mit dem mRNA- und danach mit dem Lebendimpfstoff, oder zweimal mit einem mRNA- oder Adenovirus-basiertem Impfstoff. An Gewebeproben der Nasenschleimhaut und Lunge überprüften sie dann, wie stark bei einer anschließenden Infektion mit SARS-CoV-2 die Viren die Schleimhautzellen noch angreifen konnten. Außerdem bestimmten sie das Ausmaß der Entzündungsreaktion mithilfe der Einzelzellsequenzierung.
„Der abgeschwächte Lebendimpfstoff schnitt in allen Parametern besser ab als die Vergleichsimpfstoffe“, fasst Emanuel Wyler zusammen. Ausschlaggebend dafür dürfte sein, dass der nasal verabreichte Impfstoff eine Immunität direkt an der Eintrittspforte des Virus aufbaut. Außerdem enthält der Lebendimpfstoff alle Virusbestandteile und nicht nur das Spike-Protein, wie es beim mRNA-Impfstoff der Fall ist. Spike ist zwar das wichtigste Antigen des Virus – doch das Immunsystem kann das Virus darüber hinaus an ungefähr 20 weiteren Proteinen erkennen.
Besser als herkömmliche Impfstoffe
Den besten Schutz vor dem SARS-Coronavirus 2 konnte eine zweifache Impfung über die Nase erzielen, gefolgt von der Kombination aus einer Injektion des mRNA-Impfstoffes in den Muskel und dem anschließend nasal verabreichten Lebendimpfstoff. „Das könnte den Lebendimpfstoff besonders als Booster interessant machen“, sagt Co-Erstautorin der Studie Julia Adler, Tierärztin und Doktorandin am Institut für Virologie der Freien Universität Berlin.
Das Prinzip der abgeschwächten Lebendimpfstoffe ist alt und kommt etwa bei der Masern- oder Röteln-Impfung zum Einsatz. Früher allerdings erzeugten Wissenschaftler*innen die Abschwächung zufällig, indem sie mitunter jahrelang auf Mutationen gewartet haben, die ein abgeschwächtes Virus hervorbrachten. Die Berliner Forschenden hingegen haben den genetischen Code der Coronaviren gezielt verändert. „So wollen wir verhindern, dass die abgeschwächten Viren zu einer aggressiveren Variante zurückmutieren“, erklärt Dr. Dusan Kunec, Wissenschaftler am Institut für Virologie der Freien Universität Berlin und ebenfalls Co-Letztautor. Der maßgebliche Mitentwickler des Impfstoffes betont: „Unser Lebendimpfstoff ist also sicher und kann auf neue Virusvarianten zugeschnitten werden.“
Als nächstes stehen Sicherheitsprüfungen an: Die Forschenden arbeiten dafür mit der RocketVax AG zusammen, einem Schweizer Start-up mit Sitz in Basel. Das Biotech-Unternehmen entwickelt den abgeschwächten Lebendimpfstoff gegen SARS-CoV-2 weiter und bereitet eine klinische Phase-1-Studie im Menschen vor. „Wir freuen uns sehr, dass wir mit RocketVax eine Vorreiterrolle bei der Entwicklung und Herstellung des attenuierten SARS-CoV-2-Lebendimpfstoffs in Form eines Nasensprays haben. Unser Ziel ist es, die Produktion schnell zu skalieren und die klinische Prüfung für den Marktzugang voranzutreiben und allen Menschen Schutz vor COVID-Symptomen zu bieten. Wir sehen auf dem Markt ein großes Potenzial für saisonale nasale Impfstoffe“, sagt Dr. Vladimir Cmiljanovic, CEO von RocketVax.
Welche Nasen-Impfung am Ende am besten schützt, wird die Zukunft zeigen. Die Hersteller der in Indien und China entwickelten intranasalen Adenovirus-Impfstoffe haben in Europa bislang keine Zulassung beantragt. Fest steht nach Ansicht der Forschenden allerdings: Da sie als Nasenspray oder -tropfen verabreicht werden, sind nasale Impfstoffe grundsätzlich gut geeignet für einen Einsatz bei begrenztem Zugang zu geschultem medizinischem Personal. Auch sind sie kostengünstig in der Herstellung, einfach zu lagern und zu transportieren. Nicht zuletzt können Lebendimpfstoffe wie der hier eingesetzte nachweislich einen Kreuzschutz gegen verwandte Virenstämme und somit auch SARS-CoV-2-Varianten bieten.
Über die Studie
Gefördert wurden die Arbeiten unter anderem durch die Deutsche Forschungsgemeinschaft (DFG), Förderkennzeichen OS 143/16-1 und SFB-TR84/Z01b. Zur weiteren Entwicklung des Impfstoffes arbeiten die Berliner Forschenden mit der Schweizer RocketVax AG zusammen.
Max Delbrück Center
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (Max Delbrück Center) gehört zu den international führenden biomedizinischen Forschungszentren. Nobelpreisträger Max Delbrück, geboren in Berlin, war ein Begründer der Molekularbiologie. An den Standorten in Berlin-Buch und Mitte analysieren Forscher*innen aus rund 70 Ländern das System Mensch – die Grundlagen des Lebens von seinen kleinsten Bausteinen bis zu organ-übergreifenden Mechanismen. Wenn man versteht, was das dynamische Gleichgewicht in der Zelle, einem Organ oder im ganzen Körper steuert oder stört, kann man Krankheiten vorbeugen, sie früh diagnostizieren und mit passgenauen Therapien stoppen. Die Erkenntnisse der Grundlagenforschung sollen rasch Patient*innen zugutekommen. Das Max Delbrück Center fördert daher Ausgründungen und kooperiert in Netzwerken. Besonders eng sind die Partnerschaften mit der Charité – Universitätsmedizin Berlin im gemeinsamen Experimental and Clinical Research Center (ECRC) und dem Berlin Institute of Health (BIH) in der Charité sowie dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DZHK). Am Max Delbrück Center arbeiten 1800 Menschen. Finanziert wird das 1992 gegründete Max Delbrück Center zu 90 Prozent vom Bund und zu 10 Prozent vom Land Berlin.
Freie Universität Berlin
Die Freie Universität Berlin im Südwesten der Hauptstadt ist eine junge, dynamische, international ausgerichtete Spitzenuniversität. Sie wurde 2007, 2012 und 2019 nach einem bundesweiten Wettbewerb als Exzellenzuniversität ausgezeichnet; 2019 gelang dieser Erfolg im Verbund zwischen Freier Universität Berlin, Humboldt-Universität zu Berlin, Technischer Universität Berlin und Charité – Universitätsmedizin Berlin, der gemeinsamen medizinischen Fakultät von Freier Universität und Humboldt-Universität. An der Freien Universität haben rund 460 Personen eine Professur inne; sie forschen und lehren in einem breiten Spektrum an Fächern der Geistes- und Sozialwissenschaften sowie der Natur- und Lebenswissenschaften. Gegründet wurde die Hochschule 1948 von Studierenden und Professoren als freiheitliche Antwort auf die Verfolgung systemkritischer Studenten an der Universität Unter den Linden im damaligen sowjetischen Sektor der geteilten Stadt. Die Freie Universität ist nach Zahlen der Alexander von Humboldt-Stiftung und des Deutschen Akademischen Austauschdienstes hierzulande beliebtester Ort für Spitzenforschende und für Studierende aus dem Ausland. Von dort kommt ein Fünftel der zurzeit etwa 33.500 Studierenden und ein Drittel der etwa 4.000 Promovierenden.
Charité – Universitätsmedizin Berlin
Die Charité – Universitätsmedizin Berlin ist mit rund 100 Kliniken und Instituten an vier Campi sowie 3.099 Betten eine der größten Universitätskliniken Europas. Forschung, Lehre und Krankenversorgung sind hier eng miteinander vernetzt. Mit Charité-weit durchschnittlich 20.921 und konzernweit rund 17.615 Beschäftigten aus über 100 Nationen gehört die Berliner Universitätsmedizin zu den größten Arbeitgeberinnen der Hauptstadt. Dabei waren 5.047 der Beschäftigten im Pflegebereich und 4.988 im wissenschaftlichen und ärztlichen Bereich tätig. An der Charité wurden im vergangenen Jahr 123.793 voll- und teilstationäre Fälle sowie 682.731 ambulante Fälle behandelt. Im Jahr 2021 hat die Charité Gesamteinnahmen von rund 2,3 Milliarden Euro, inklusive Drittmitteleinnahmen und Investitionszuschüssen, erzielt. Mit den 215,8 Millionen Euro eingeworbenen Drittmitteln erreichte die Charité einen erneuten Rekord. An der gemeinsamen medizinischen Fakultät von Freier Universität Berlin und Humboldt-Universität zu Berlin, die zu den größten in Deutschland gehört, werden mehr als 9.000 Studierende in Humanmedizin, Zahnmedizin sowie Gesundheitswissenschaften ausgebildet. Darüber hinaus gibt es 730 Ausbildungsplätze in 11 Gesundheitsberufen und 111 Ausbildungsplätze in 8 weiteren Berufen. Die Berliner Universitätsmedizin setzt Akzente in den Forschungsschwerpunkten: Infektion, Inflammation und Immunität einschließlich Forschung zu COVID-19, Kardiovaskuläre Forschung und Metabolismus, Neurowissenschaften, Onkologie, Regenerative Therapien sowie Seltene Erkrankungen und Genetik. Wissenschaftlerinnen und Wissenschaftler der Charité arbeiten unter anderem in 28 DFG-Sonderforschungsbereichen, darunter sieben mit Sprecherfunktion, in drei Exzellenzclustern, davon eines mit Sprecherschaft, 10 Emmy-Noether-Nachwuchsgruppen, 14 Grants des European Research Councils und 8 europäischen Verbundprojekten mit Charité-Koordination.
Wissenschaftliche Ansprechpartner:
Dr. Jakob Trimpert
Arbeitsgruppenleiter / Leiter der Diagnostik
Institut für Virologie
Freie Universität Berlin
+49 (0)30 838 650 288
Jakob.Trimpert@fu-berlin.de
Dr. Emanuel Wyler
Wissenschaftler in der Arbeitsgruppe „RNA-Biologie und Posttranscriptionale Regulation“
Max Delbrück Center
+49 (0)30 9406 3009
emanuel.wyler@mdc-berlin.de
Dr. Geraldine Nouailles
Arbeitsgruppenleiterin
Klinik für Pneumologie, Beatmungsmedizin und Intensivmedizin mit Arbeitsbereich Schlafmedizin
Charité – Universitätsmedizin Berlin
+49 (0)30 450 553 347
geraldine.nouailles@charite.de
Originalpublikation:
Geraldine Nouailles et al. (2023): A live attenuated vaccine confers superior mucosal and systemic immunity to SARS-CoV-2 variants, in: Nature Microbiology, DOI: 10.1038/s41564-023-01352-8
Weitere Informationen:
https://www.mdc-berlin.de/de/landthaler – AG Landthaler am MDC-BIMSB
https://www.vetmed.fu-berlin.de/index.html – Veterinärmedizin an der FU Berlin
https://infektiologie-pneumologie.charite.de/ueber_den_faecherverbund/ – infektiologie, Pneumologie und Intensivmedizin ander Charite
http://www.rocketvax.com – RocketVax
https://www.mdc-berlin.de/de/news/press/lungenschaeden-bei-covid-19-erkrankungen… – PM zu voriger Publikation
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Größte bisher bekannte magnetische Anisotropie eines Moleküls gemessen
An der Berliner Synchrotronstrahlungsquelle BESSY II ist es gelungen, die größte magnetische Anisotropie eines einzelnen Moleküls zu bestimmen, die jemals experimentell gemessen wurde. Je größer diese Anisotropie ist, desto besser…

Tsunami-Frühwarnsystem im Indischen Ozean
20 Jahre nach der Tsunami-Katastrophe… Dank des unter Federführung des GFZ von 2005 bis 2008 entwickelten Frühwarnsystems GITEWS ist heute nicht nur der Indische Ozean besser auf solche Naturgefahren vorbereitet….

Resistente Bakterien in der Ostsee
Greifswalder Publikation in npj Clean Water. Ein Forschungsteam des Helmholtz-Instituts für One Health (HIOH) hat die Verbreitung und Eigenschaften von antibiotikaresistenten Bakterien in der Ostsee untersucht. Die Ergebnisse ihrer Arbeit…



