Schlüsselgen der Hodentumor-Entwicklung entdeckt
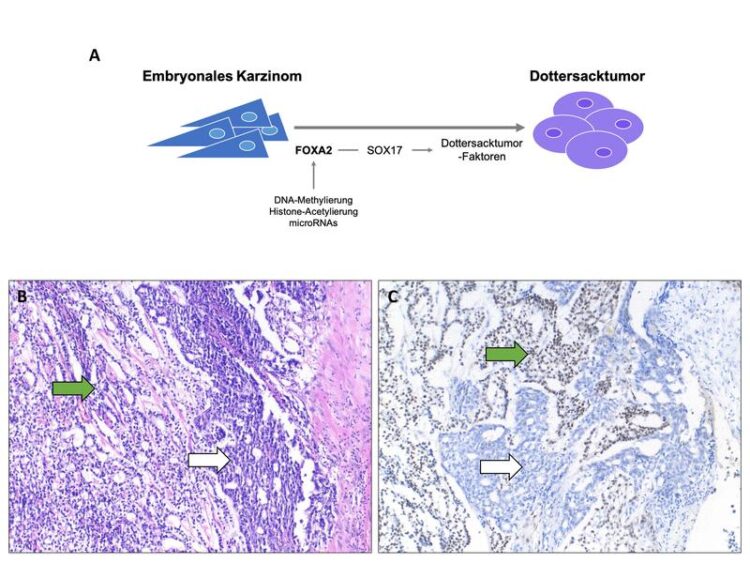
Die Bildung von Dottersacktumoren aus embryonalen Karzinomen könnte das Ergebnis einer durch die Mikroumgebung ausgelösten Hochregulation von FOXA2 sein.
© Felix Bremmer, Göttingen
Düsseldorfer und Göttinger Forscher identifizieren neuen Biomarker
Hodentumoren stellen die häufigsten soliden Tumoren des jungen Mannes im Alter von 15 bis 44 Jahren dar. Ein Subtyp der Hodentumoren, der Dottersacktumor, zeigt sich besonders resistent gegenüber der Standard-Chemotherapie. Die molekularen Mechanismen, die zur Dottersacktumor-Entwicklung und deren Resistenz führen, sind nahezu unverstanden.
Gefördert von der Wilhelm Sander-Stiftung konnten Düsseldorfer und Göttinger Forscher nun in Kooperation den Pionier- und Differenzierungsfaktor FOXA2 als Schlüsselgen dieser Tumorentwicklung identifizieren. Dies ermöglicht neben einem besseren Verständnis der molekularen Tumorcharakteristika auch die Etablierung neuer Diagnose- und Therapieansätze.
Hodentumoren, auch Keimzelltumoren genannt, repräsentieren in der Altersgruppe zwischen dem 15. und 45. Lebensjahr den häufigsten malignen Tumor des jungen Mannes und die Inzidenz der Keimzelltumoren ist in den letzten Jahren stetig gestiegen. Die Mortalitätsrate konnte mit Einführung der Chemotherapien mit Platinderivaten deutlich gesenkt werden, sodass heute über 90 Prozent der Patienten geheilt werden können. Jedoch spricht eine Gruppe von Keimzelltumorpatienten nicht auf eine medikamentöse Tumortherapie an und ist auch mit chirurgischen Verfahren nicht mehr zu heilen.
Keimzelltumoren werden in Seminome und Nicht-Seminome unterteilt. Beide entstehen aus einer gemeinsamen Vorläuferläsion, der sogenannten „Keimzellneoplasie in situ“ (GCNIS; aus dem Englischen für „germ cell neoplasia in situ“). Dabei handelt es sich um Krebsvorläuferzellen, die auf das Ursprungsgewebe – hier die Hoden – begrenzt sind. Seminome ähneln in ihrem Aussehen, ihrem Genexpressionsprofil und der Epigenetik sehr stark den GCNIS-Zellen. Die Nicht-Seminome hingegen besitzen ihre eigene Stammzellpopulation, das Embryonale Karzinom. Dieses ist in der Lage – wie embryonale Stammzellen – in Zellen aller Gewebearten zu differenzieren und folglich alle möglichen Gewebe des Embryos zu imitieren. Eine Besonderheit der Embryonalen Karzinome ist, dass sie auch in extra-embryonale Gewebe (also Gewebe, die nicht zum Embryo gehören) differenzieren und sich so unter anderem zu sogenannten „Dottersacktumoren“ entwickeln können. Klinisch haben Patienten mit Dottersacktumoren eine schlechte Prognose, da diese Tumoren einen hohen Anteil an der Keimzelltumor-verbundenen Sterblichkeit besitzen und häufig eine Resistenz gegenüber der Cisplatin-basierten Standard-Chemotherapie ausbilden.
Gefördert von der Wilhelm Sander-Stiftung verfolgen Wissenschaftler* um Prof. Dr. rer. nat. Daniel Nettersheim vom Urologischen Forschungslabor des Bereichs Translationale UroOnkologie der Klinik für Urologie am Universitätsklinikum Düsseldorf und PD Dr. med. Felix Bremmer vom Institut für Pathologie an der Universitätsmedizin Göttingen im Rahmen von zwei unabhängigen Forschungsprojekten das Ziel, die bislang nahezu unverstandenen molekularen und (epi)genetischen Mechanismen zu bestimmen, welche die Differenzierung von Embryonalen Karzinomen in Dottersacktumoren steuern. Dadurch wollen die Forscher nicht nur das grundlegende Verständnis dieser Tumoren erweitern, sondern auch neue Zielmoleküle für zukünftige Therapien und neue Biomarker zur Diagnose der Dottersacktumoren in der pathologischen Routinediagnostik identifizieren.
In Kooperation konnten die Wissenschaftler beider Universitäten jetzt durch die vergleichende Analyse von Dottersacktumor- und Embryonalen Karzinom-Geweben und -Zelllinien im Hinblick auf deren Unterschiede auf DNA-, RNA- und Protein-Ebene zeigen, dass der Pionier- und Transkriptionsfaktor FOXA2 einen Schlüsselfaktor in der Dottersacktumor-Entwicklung darstellt. Dabei interagiert FOXA2 vermutlich mit einem weiteren Transkriptionsfaktor (SOX17), um die Genexpession typischer Dottersacktumor-assoziierter Gene und Signalwege zu regulieren und damit die Differenzierung eines Embryonalen Karzinoms in einen Dottersacktumor zu induzieren.
Darüber hinaus konnte das Forscherteam um Daniel Nettersheim und Felix Bremmer an über 350 verschiedenen Keimzelltumor-Geweben zeigen, dass sich der immunhistochemische Nachweis des FOXA2-Proteins, also prinzipiell eine Antikörper-basierte Markierung, als vielversprechender Biomarker in der Diagnostik eignen könnte. „Durch den FOXA2-Nachweis ist es uns gelungen, nicht nur eindeutig Dottersacktumoren von den anderen Keimzelltumortypen zu unterscheiden, sondern auch kleine Dottersacktumor-Anteile in gemischten Keimzelltumoren nachzuweisen, die sonst möglicherweise unentdeckt geblieben wären und die Therapie nachteilig beeinflusst hätten“, erläutert Felix Bremmer diesen wesentlichen Befund der gemeinsamen Untersuchungen. „Im Rahmen unserer Arbeiten konnten wir das grundsätzliche Verständnis der Dottersacktumor-Entwicklung bereits deutlich erweitern, neue Therapieziele identifizieren und mit FOXA2 zudem einen neuer Biomarker etablieren“, fasst Daniel Nettersheim die vielversprechenden Studienergebnisse der beiden Forschungsgruppen noch einmal zusammen. Diese Ergebnisse wurden jüngst im renommierten Journal of Cellular and Molecular Medicine publiziert.
Basierend auf diesen Erkenntnissen und zukünftiger weiterführender Forschung, erhoffen sich die Wissenschaftler, die Diagnostik und Therapiemöglichkeiten von Dottersacktumor-Patienten verbessern zu können und so die mit diesen Tumoren verbundene Sterblichkeit zu senken. In einem bereits gestarteten und ebenfalls durch die Wilhelm Sander-Stiftung geförderten Forschungsprojekt untersucht Daniel Nettersheim daher zurzeit, welchen Einfluss auch das Mikromilieu unter anderem auf die Dottersacktumor-Entwicklung hat.
Ergänzung zur Abbildung:
Die Bildung von Dottersacktumoren aus embryonalen Karzinomen könnte das Ergebnis einer durch die Mikroumgebung ausgelösten Hochregulation von FOXA2 sein (A). Mikroskopisches Bild eines embryonalen Karzinoms (weißer Pfeil) und eines Dottersacktumors (grüner Pfeil) (B). In immunhistochemischen Anfärbungen ist das FOXA2-Protein in Dottersacktumoren positiv (grüner Pfeil, braune Signale), embryonale Karzinome werden nicht angefärbt (weißer Pfeil) (C).
* Die in diesem Text verwendeten Genderbegriffe vertreten alle Geschlechtsformen.
Wilhelm Sander-Stiftung: Partner innovativer Krebsforschung
Die Wilhelm Sander-Stiftung hat das Forschungsprojekt von PD Dr. med. Felix Bremmer an der Universitätsmedizin Göttingen in bislang zwei Förderphasen mit insgesamt rund 250.000 Euro unterstützt. Das weiterführende Forschungsprojekt von Prof. Dr. rer. nat. Daniel Nettersheim am Universitätsklinikum Düsseldorf wird aktuell mit rund 114.000 Euro gefördert.
Stiftungszweck ist die Förderung der medizinischen Forschung, insbesondere von Projekten im Rahmen der Krebsbekämpfung. Seit Gründung der Stiftung wurden insgesamt über 250 Millionen Euro für die Forschungsförderung in Deutschland und der Schweiz ausbezahlt. Damit ist die Wilhelm Sander-Stiftung eine der bedeutendsten privaten Forschungsstiftungen im deutschen Raum. Sie ging aus dem Nachlass des gleichnamigen Unternehmers hervor, der 1973 verstorben ist.
Kontakt:
Henrike Boden
Wilhelm Sander-Stiftung
Presse- und Öffentlichkeitsarbeit & Stiftungskommunikation
Tel.: +49 (0) 89 544187-0
Fax: +49 (0) 89 544187-20
E-Mail: boden@sanst.de
Stefan Weller
Pressesprecher und Leiter Unternehmenskommunikation, Presse- und Öffentlichkeitsarbeit
Universitätsmedizin Göttingen, Georg-August-Universität
Von-Siebold-Str. 3
37075 Göttingen
Postfach 37099 Göttingen
Tel.: +49 (0) 551 39-61020
Fax: +49 (0) 551 39-61023
E-Mail: presse.medizin@med.uni-goettingen.de
Susanne Dopheide
Heinrich-Heine-Universität Düsseldorf
Stabsstelle Presse und Kommunikation / Medizinisches Dekanat
Tel.: +49 (0) 211 8104173
E-Mail: susanne.dopheide@med.uni-duesseldorf.de
Wissenschaftliche Ansprechpartner:
Prof. Dr. rer. nat. Daniel Nettersheim
Klinik für Urologie
Urologisches Forschungslabor
Translationale UroOnkologie
Universitätsklinikum Düsseldorf
Universitätsstraße 1
40225 Düsseldorf
Tel.: +49 (0) 211 81-15844
E-Mail: Daniel.Nettersheim@med.uni-duesseldorf.de
https://www.uniklinik-duesseldorf.de/patienten-besucher/klinikeninstitutezentren…
PD Dr. med. Felix Bremmer
Oberarzt
Institut für Pathologie
Universitätsmedizin Göttingen
Robert-Koch-Str.40
37075 Göttingen
Tel.: +49 (0) 551 3966857
E-Mail: Felix.Bremmer@med.uni-goettingen.de
https://pathologie.umg.eu/forschung/hodentumoren/
Originalpublikation:
Wruck W, Bremmer F, Kotthoff M, Fichtner A, Skowron MA, Schönberger S, Calaminus G, Vokuhl C, Pfister D, Heidenreich A, Albers P, Adjaye J, Nettersheim D. The pioneer and differentiation factor FOXA2 is a key driver of yolk-sac tumour formation and a new biomarker for paediatric and adult yolk-sac tumours. J Cell Mol Med. 2021 Jan 14. doi: 10.1111/jcmm.16222. Epub ahead of print.
https://onlinelibrary.wiley.com/doi/10.1111/jcmm.16222
Weitere Informationen:
https://www.wilhelm-sander-stiftung.de/
https://pathologie.umg.eu/forschung/hodentumoren/
https://www.uniklinik-duesseldorf.de/nc/ueber-das-ukd/presse-publikationen/press…
https://www.umg.eu/de/presse/
https://gccc.umg.eu/
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Parallele Pfade: Das Verständnis von Malariaresistenz bei Schimpansen und Menschen
Die nächsten Verwandten des Menschen passen sich genetisch an Lebensräume und Infektionen an Überleben des am besten Angepassten: Genetische Anpassungen bei Schimpansen aufgedeckt Görlitz, 10.01.2025. Schimpansen verfügen über genetische Anpassungen,…

Du bist, was du isst – Stanford-Studie verbindet Ballaststoffe mit Modulation von Anti-Krebs-Genen
Die Ballaststofflücke: Ein wachsendes Problem in der amerikanischen Ernährung Ballaststoffe sind bekanntlich ein wichtiger Bestandteil einer gesunden Ernährung, doch weniger als 10 % der Amerikaner konsumieren die empfohlene Mindestmenge. Eine…

Vertrauen Sie Ihrem Bauchgefühl – RNA-Protein-Entdeckung für eine bessere Immunität
HIRI-Forscher entschlüsseln Kontrollmechanismen der Polysaccharidverwertung in Bacteroides thetaiotaomicron. Forschende des Helmholtz-Instituts für RNA-basierte Infektionsforschung (HIRI) und der Julius-Maximilians-Universität (JMU) Würzburg haben ein Protein sowie eine Gruppe kleiner Ribonukleinsäuren (sRNAs) in…



