Vom Feind manipuliert
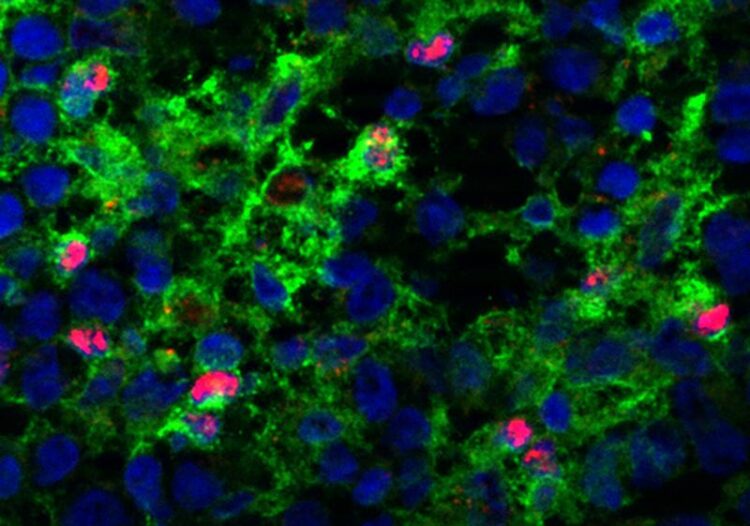
Ein Team am MDC hat eine bisher unerwartete Rolle des Transkriptionsfaktors C/EBP bei der Reifung und immunogenen Funktionalität von dendritischen Zellen (in rot) der Maus entschlüsselt.
AG Rehm/Höpken, MDC
Bestimmte Zellen des Immunsystems können Tumore für die körpereigene Abwehr gut sichtbar machen – würden Krebszellen sie nicht daran hindern. Forschende u.a. des MDC und ECRC publizieren nun gemeinsam in PNAS, wie Tumore Immunzellen in ihrer unmittelbaren Umgebung blockieren.
Dendritische Zellen sind für die Abwehr von Viren, Bakterien und auch Tumorzellen sehr wichtig, weil sie Merkmale fremder Zellen, die Fremdantigene, aufnehmen, um sie dem Immunsystem zu präsentieren. Aber nur eine ausgereifte dendritische Zelle kann dies –und schafft es darüber eine schützende Immunantwort auszulösen. Ist sie unreif fördert sie dagegen eine Immuntoleranz.
In der Umgebung von Lymphomen und Leukämien – Krebserkrankungen des lymphatischen Systems – fand das Team um die Forschenden Dr. Uta Höpken und Dr. Armin Rehm vom Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) jedoch erstaunlich viele unreife dendritische Zellen.
„Unreif unterstützen sie sogar noch das Tumorwachstum, durch Freisetzung bestimmter Botenstoffe“, erklärt Höpken. In Kontakt mit Tumorzellen sei der Transkriptionsfaktor C/EBPβ hochreguliert, was die Reifung der dendritischen Zellen unterbindet. Der Tumor manipuliert demnach aktiv das Immunsystem von Krebspatient*innen zu seinen Gunsten.
Dies zeigt das MDC-Team in Zusammenarbeit unter anderem mit Forschenden der Universitätsmedizin Münster in ihrer aktuellen Publikation im Fachjournal Proceedings National Academy of Science, USA (PNAS). Auch das Experimental and Clinical Research Center (ECRC), eine gemeinsamen Einrichtung von MDC und der Charité – Universitätsmedizin Berlin, hat an der Studie mitgewirkt. Diese Arbeit wurde von der Wilhelm Sander-Stiftung finanziert.
Molekularer Schalter hält die Balance
Die Mikroumgebung von Tumoren des Lymph- und Blutsystems wird am MDC schon seit vielen Jahren erforscht. Dafür wurden Mausmodelle entwickelt, die Lymphome und Leukämien ausbilden können. Bereits vor einiger Zeit fanden Höpken und Rehm heraus, dass der Transkriptionsfaktor C/EBPβ der entscheidende molekulare Schalter ist, der die Reifung dendritischer Zellen reguliert.
In der neuen Studie zeigen sie, dass bei transgenen Mäusen, denen das Gen für das Schalterprotein fehlt, dendritische Zellen – im Vergleich zu Kontrolltieren – unkontrolliert ausreifen. „Daraus schlossen wir, dass für eine normale Reifung und Funktionalität von dendritischen Zellen dieser Schalter in seiner Aktivität reguliert werden muss“. Ein bestimmter Level des Schalterproteins ist immer vorhanden. „Wir konnten experimentell zeigen, dass ausgereifte dendritische Zellen niedrige C/EBPβ Level aufweisen, während unreife dendritische Zellen hohe C/EBPβ Mengen tragen“, erklärt Höpken.
Erst die zeitlich regulierte Entwicklung von einem unreifen in ein reifes Stadium ermöglicht die volle Funktionstüchtigkeit einer dendritischen Zelle: Die unreife Zelle nimmt Fremdantigene auf, die gereifte präsentiert das verarbeitete Antigen.
Der komplette Verlust von C/EBPβ führte dazu, dass dieser Zelltyp unkontrolliert ausreifte, sodass er nur noch verringert Fremdantigene aufnehmen konnte. Tumorzellen können aktiv in diesen Regelungsprozess eingreifen. Sie blockieren die körpereigene Immunabwehr, indem sie durch Hochregulation von C/EBPβ die Ausreifung verhindern. „Die zeitliche Balance dieser Schalteraktivität ist somit ganz entscheidend für die Funktionstüchtigkeit dieser Zellen“, sagt Höpken.
Wirkung der mTOR-Signalweg Hemmung bei Krebs neu interpretiert
Nicht nur dendritische Zellen verfügen über diesen molekularen Schalter. Er reguliert auch Genexpression, Reifung und Vermehrung vieler anderer Körperzellen – so auch der Tumorzellen selbst. Mit Medikamenten wie dem Immunsuppressivum Rapamycin lässt sich C/EBPβ-Produktion regelrecht stilllegen. Denn die Bildung des Schalterproteins wird wesentlich über den mTOR-Signalweg reguliert – und diesen blockiert das Immunsuppressivum.
„Inhibitoren des mTOR-Signalweges wurden in der Krebstherapie wegen ihrer Zellwachstum hemmenden Wirkung schon eingesetzt. Doch bisher dachte man, dass die Wirkung ausschließlich auf die Tumorzellen selbst oder die Gefäßzellen im Tumor beschränkt ist“, sagt Rehm.
„Aufgrund unserer Untersuchungen nehmen wir an, dass mTOR-Blocker über den gleichen Mechanismus auch auf die Immunzellen in unmittelbarer Nähe des Tumors wirken.“ Die Unterdrückung der C/EBPβ-Aktivität in dendritischen Zellen hat damit zwei therapeutische Effekte: Zum einen wird so die Ausschüttung von Botenstoffen und Wachstumsfaktoren unterbunden, welche die Lymphomzellen fördern. Zum anderen unterstützt die Ausreifung auch die Aktivierung von anderen schützenden Immunzellen.
Tumor-Mikroumgebung als neues Target für die Krebstherapie
„Wir wissen heute, dass Tumorzellen allein nicht existieren können. Nicht einmal sehr aggressive Lymphome. Sie benötigen Unterstützung aus ihrer nächsten Umgebung, und das wurde lange unterschätzt“, betont Rehm. „Aber die Mikroumgebung des Tumors – so, unsere Hypothese – fördert eben leider auch Rezidive.“ Auch nach einer erfolgreichen Chemotherapie bleiben häufig einzelne Tumorstammzellen zurück sowie Stromazellen, die Stützfunktionen im Gewebe ausüben. In dieser Nische könne die Erkrankung erneut aufflammen. „Möglicherweise wird das Wachstum von versprengten Tumorzellen durch Stromazellen und molekulare Schalter wie dem Transkriptionsfaktor C/EBPb dendritischer Zellen unterstützt.“
Die Ausreifung stimulieren
Die Reifung dendritischer Zellen zu unterstützen, könnte ein komplementärer Ansatz für die Krebstherapie sein. Es gibt bereits Medikamente, die den Reifestatus dieser Zellen verbessern, indem sie an Oberflächenrezeptoren, wie den bekannten Toll-like-Rezeptoren, andocken. Eine begleitende, immunstärkende Behandlung mit solchen Mitteln während einer Chemo- oder Antikörpertherapie wäre demnach sehr nützlich. „Das Problem der Reifeblockade von dendritischen Zellen ist klinisch erkannt“, sagt Rehm abschließend. „Wir haben damit ein neues Angriffsziel gefunden und gezeigt, dass es sinnvoll ist in diesen Prozess einzugreifen. Das ist ein Anstoß für Wirkstoff- und Targetscreening von Pharmafirmen.“
Wissenschaftliche Ansprechpartner:
Dr. Uta Höpken
AG Mikroumgebung als Regulator bei Autoimmunität und Krebs
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
+49-30-9406-3330
uhoepken@mdc-berlin.de
Dr. Armin Rehm
AG Translationelle Tumorimmunologie
Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC)
+49-30-9406-3817
arehm@mdc-berlin.de
Originalpublikation:
Florian Scholz et al. (2020): “The transcription factor C/EBPβ orchestrates dendritic cell maturation and functionality under homeostatic and malignant conditions,” PNAS, DOI: 10.1073/pnas.2008883117
Weitere Informationen:
https://www.pnas.org/content/early/2020/09/30/2008883117 (Originalpubnlikation)
https://www.mdc-berlin.de/de/news/news/vom-feind-manipuliert (Meldung auf der MDC-Website
https://www.mdc-berlin.de/rehm AG Rehm
https://www.mdc-berlin.de/hoepken AG Höpken
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Du bist, was du isst – Stanford-Studie verbindet Ballaststoffe mit Modulation von Anti-Krebs-Genen
Die Ballaststofflücke: Ein wachsendes Problem in der amerikanischen Ernährung Ballaststoffe sind bekanntlich ein wichtiger Bestandteil einer gesunden Ernährung, doch weniger als 10 % der Amerikaner konsumieren die empfohlene Mindestmenge. Eine…

Vertrauen Sie Ihrem Bauchgefühl – RNA-Protein-Entdeckung für eine bessere Immunität
HIRI-Forscher entschlüsseln Kontrollmechanismen der Polysaccharidverwertung in Bacteroides thetaiotaomicron. Forschende des Helmholtz-Instituts für RNA-basierte Infektionsforschung (HIRI) und der Julius-Maximilians-Universität (JMU) Würzburg haben ein Protein sowie eine Gruppe kleiner Ribonukleinsäuren (sRNAs) in…

ASXL1-Mutation: Der verborgene Auslöser hinter Blutkrebs und Entzündungen
Wissenschaftler zeigen, wie ein mutiertes Gen rote und weiße Blutkörperchen schädigt. LA JOLLA, CA – Wissenschaftler am La Jolla Institute for Immunology (LJI) haben herausgefunden, wie ein mutiertes Gen eine…



