Vom Krebsmedikament zur Virustherapie: neue Angriffspunkte bei der Bekämpfung des Cytomegalovirus
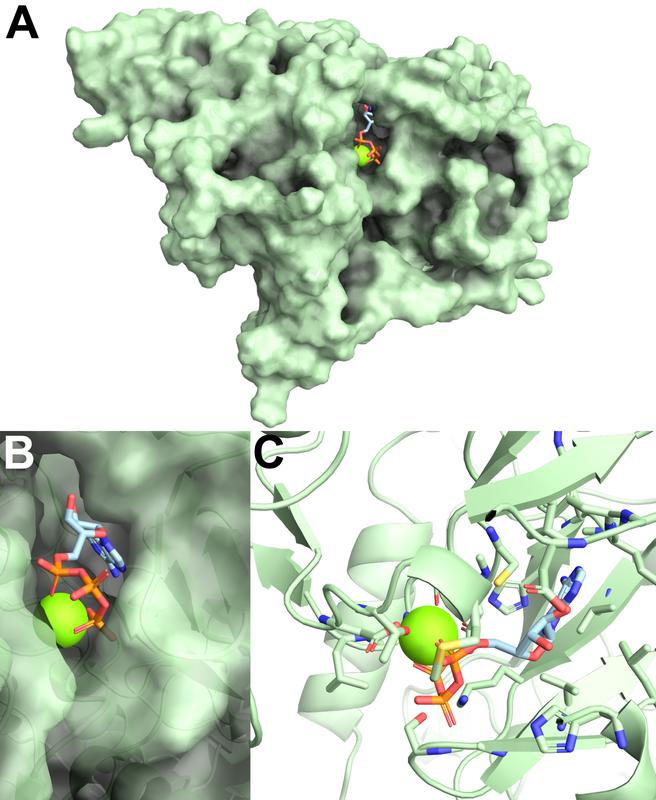
(A) pUL97 in Oberflächenpräsentation. (B) Vergrößerung der Bindestelle. (C) Bindestellen-definierende Aminosäuren sind als Stäbchen farbig dargestellt Arbeitsgruppe Prof. Dr. Marschall
Mit dem Ziel, ein neues antivirales Medikament zu entwickeln, erprobt Prof. Dr. Manfred Marschall, Forschungsgruppenleiter am Virologischen Institut des Universitätsklinikums Erlangen, mit seinem Team ganz spezielle Angriffspunkte bei der Bekämpfung des Cytomegalovirus. Finanziert wird das Projekt von der Wilhelm Sander-Stiftung, eine der größten deutschen Förderstiftungen im Bereich medizinischer Forschung.
„Infektionen mit humanen Herpesviren, wie dem Cytomegalovirus, ähneln in mehrerlei Hinsicht den molekularen Vorgängen bei Krebserkrankungen: In beiden Fällen werden Gewebezellen zur Teilung angeregt, es werden Signalabläufe in den Zellen hochreguliert und Proteine in ihrer Funktion fehlgeleitet“, erklärt Prof. Dr. Marschall und fügt hinzu: „Um eine Methode zur Bekämpfung des Cytomegalovirus zu entwickeln, setzen wir daher auf die Funktionsweise bestimmter Krebsmedikamente.“
Viele in der Krebstherapie eingesetzte Arzneimittel wirken auf Basis sogenannter Kinase-Inhibitoren. Diese hemmen verschiedene zelluläre Proteinkinasen, die für das Wachstum der Krebszellen verantwortlich sind. Proteinkinasen sind Enzyme, die bestimmte Proteine gezielt verändern und in ihrer Aktivität steuern, sodass es zu einer unkontrollierten Zellteilung und damit zum Voranschreiten der Tumorbildung kommt.
Die Entwicklung von Kinase-Inhibitoren für den Einsatz als Medikamente wurde besonders durch die genaue Kenntnis der molekularen Proteinstrukturen vorangetrieben – denn wenn die Bausteine (Aminosäuren) der Proteinkinase und deren Struktur bekannt sind, kann ein passender Inhibitor gefunden werden, der in der Lage ist, an die Proteinkinase zu binden, sie zu hemmen und damit die Zellteilung einzudämmen.
Antivirale Wirkstoffe lassen sich in Krebsmedikamenten finden
In Bezug auf das Cytomegalovirus konnte Prof. Dr. Manfred Marschall zeigen, dass die viruseigene Proteinkinase („pUL97“) den zellulären Kinasen, also denjenigen bei Krebserkrankungen, ähnelt. Im Rahmen seiner Forschungsarbeit analysierte er mit seinem Team die Cytomegalovirus-Proteinkinase pUL97 grundlegend, sowohl funktionell, strukturell als auch in ihrer Wechselwirkung mit der Zielzelle. Ziel war es auch hier, den Aufbau und die Zusammensetzung möglichst exakt zu bestimmen, um im Anschluss mögliche Inhibitoren zu finden beziehungsweise in ihrer Anwendung als „Medikamentenkandidaten“ zu entwickeln.
Zur genauen Strukturbestimmung von zellulären Kinasen bei Krebserkrankungen wird herkömmlicherweise ein Verfahren eingesetzt, das auf einer Kristallisation des Proteins sowie einer anschließenden Röntgenstrukturanalyse basiert: Durch einen physikalisch-chemischen Prozess wird aus dem Protein ein Kristall gebildet. Denn nur in dieser komprimierten Form, ist es möglich, anhand der Beugung der Röntgenstrahlen ein 3D-Modell zu erstellen, das die verschiedenen Bausteine des Proteins und deren Zusammensetzung abbildet.
Die Struktur der viralen Proteinkinase pUL97 mit dem oben beschriebenen Verfahren der Kristallisation und Röntgenstrukturanalyse exakt abzubilden, ist derzeit noch nicht gelungen. Die Forscher fanden jedoch eine andere vielversprechende Methode: Mittels Computersimulation wurden verschiedene ähnliche Kinasen mit bekannten Strukturen „übereinandergelegt“ und dadurch eine Vorhersage für die Struktur der viralen Proteinkinase pUL97 erstellt.
Der Aufbau der Kinase wurde in einem 3D-Modell simuliert, das mögliche „Bindetaschen“ zeigt, also Bereiche, an denen Inhibitoren zur Hemmung des krankheitsverursachenden Prozesses „andocken“ können (siehe Abbildung 1). Auf Basis dieser Vorhersage lassen sich nun verschiedene Wirkstoffe auf deren Eignung als Inhibitoren analysieren beziehungsweise werden chemisch so weiterentwickelt, dass sie einen geeigneten Inhibitor darstellen. Eine Gruppe von Wirkstoffen (sogenannte „Quinazolin-Moleküle“ aus der Gruppe um das Krebsmedikament „Iressa“), die das Team bereits genau untersucht hat, ist so gut geeignet, dass sich daraus ein antivirales Medikament entwickeln ließe.
Hier hofft das Team des Universitätsklinikums Erlangen nun darauf, durch Unterstützung eines Pharmaunternehmens die Medikamentenentwicklung weiter vorantreiben zu können. „Wir haben gezeigt, dass die Methode funktioniert und einen Prototypen entwickelt. Nun ist weitere Unterstützung gefragt, um die Entwicklung eines marktreifen Medikaments zu realisieren“, so Prof. Dr. Manfred Marschall.
Publikationen
Hutterer, C., Milbradt, J., Hamilton, S., Zaja, M., Leban, J., Henry, C., Steingruber, M., Sonntag, E., Zeitträger, I., Bahsi, H., Stamminger, T., Rawlinson, W.D., Strobl, S. & Marschall, M. (2017). Inhibitors of dual-specificity tyrosine phosphorylation-regulated kinases (DYRK) exert a strong anti-herpesviral activity. Antiviral Res. 143: 113-121.
Held, F.E., Guryev, A.A., Fröhlich, T., Hampel, F., Kahnt, A., Hutterer, C., Steingruber, M., Bahsi, H., von Bojničić-Kninski, C., Mattes, D.S., Foertsch, T.C., Nesterov-Mueller, A., Marschall, M & Tsogoeva, S.B. (2017). Facile access to novel antiviral quinazoline heterocycles with fluorescence properties via merging metal-free domino reactions. Nature Comm. 8: 15071 DOI 10.1038/ncomms15071.
Hutterer, C., Hamilton, S., Steingruber, M., Zeitträger, I., Thuma, N., Naing, Z., Örfi, Z., Örfi, L., Socher, E., Sticht, H., Rawlinson, W.D., Chou, S., Haupt, V.J. & Marschall, M. (2016). The chemical class of quinazoline compounds provides a core structure for the design of anticytomegaloviral kinase inhibitors. Antiviral Res. 134: 130-143.
Milbradt, J., Hutterer, C., Bahsi, H., Wagner, S., Horn, A.H.C., Kaufer, B.B., Mori, Y., Sticht, H., Fossen, F. & Marschall, M. (2016). The prolyl isomerase Pin1 promotes the herpesvirus-induced phosphorylation-dependent disassembly of the nuclear lamina required for nucleocytoplasmic egress. PLoS Pathog. 12: e1005825.
Steingruber, M., Kraut, A., Socher, E., Sticht, H., Reichel, A., Stamminger, T., Amin, B., Couté, Y., Hutterer, C. & Marschall, M. (2016). Proteomic interaction patterns between human cyclins, the cyclin-dependent kinase ortholog pUL97 and additional cytomegalovirus proteins. Viruses 8: doi 10.3390/v8080219.
Walzer, S.A., Egerer-Sieber, C., Sticht, H., Sevvana, M., Hohl, H., Milbradt, M., Muller, Y.A. & Marschall, M. (2015). Crystal structure of the human cytomegalovirus pUL50-pUL53 core nuclear egress complex provides insight into a unique assembly scaffold for virus-host protein interactions.
Kontakt
Prof. Dr. Manfred Marschall
Professor für Virologie
Virologisches Institut des Universitätsklinikums Erlangen, Friedrich-Alexander-Universität Erlangen-Nürnberg, Medizinische Fakultät
Schlossgarten 4, 91054 Erlangen
Tel. (09131) 8526089
Email manfred.marschall@viro.med.uni-erlangen.de
Die Wilhelm Sander-Stiftung unterstützte dieses von Prof. Dr. Manfred Marschall initiierte und umgesetzte Forschungsprojekt mit über 196.000 Euro. Ihr Stiftungszweck ist die Förderung der medizinischen Forschung, insbesondere von Projekten im Rahmen der Krebsbekämpfung. Seit Gründung der Stiftung wurden insgesamt über 220 Millionen Euro für die Forschungsförderung in Deutschland und der Schweiz bewilligt. Damit ist die Wilhelm Sander-Stiftung eine der bedeutendsten privaten Forschungsstiftungen im deutschen Raum. Sie ging aus dem Nachlass des gleichnamigen bayerischen Unternehmers hervor, der 1973 verstorben ist.
Weitere Informationen zur Stiftung: http://www.wilhelm-sander-stiftung.de
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Sensoren für „Ladezustand“ biologischer Zellen
Ein Team um den Pflanzenbiotechnologen Prof. Dr. Markus Schwarzländer von der Universität Münster und den Biochemiker Prof. Dr. Bruce Morgan von der Universität des Saarlandes hat Biosensoren entwickelt, mit denen…

Organoide, Innovation und Hoffnung
Transformation der Therapie von Bauchspeicheldrüsenkrebs. Bauchspeicheldrüsenkrebs (Pankreaskarzinom) bleibt eine der schwierigsten Krebsarten, die es zu behandeln gilt, was weltweite Bemühungen zur Erforschung neuer therapeutischer Ansätze anspornt. Eine solche bahnbrechende Initiative…

Leuchtende Zellkerne geben Schlüsselgene preis
Bonner Forscher zeigen, wie Gene, die für Krankheiten relevant sind, leichter identifiziert werden können. Die Identifizierung von Genen, die an der Entstehung von Krankheiten beteiligt sind, ist eine der großen…



