Wie resistente Keime Gift auf molekularer Ebene transportieren
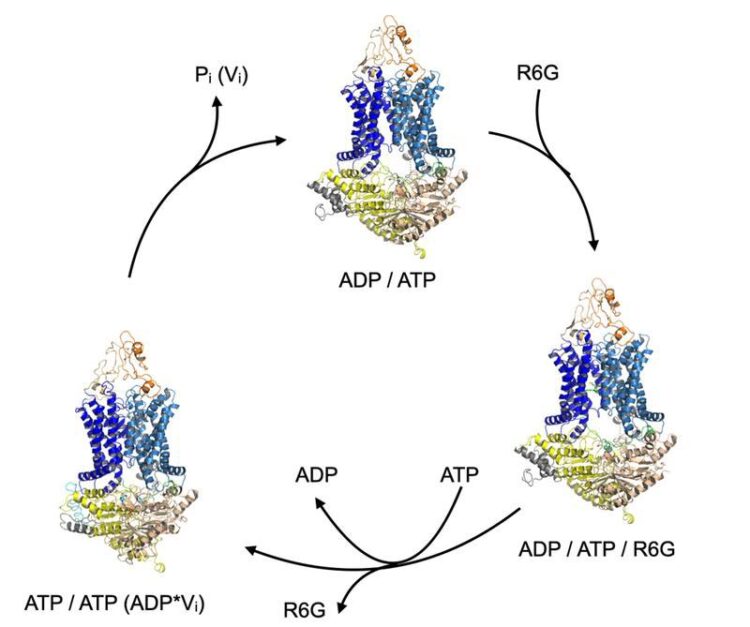
Transportzyklus des ABC-Transporters Pdr5 (orange/ blau / gelb), Zyklus durch Bindung und Hydrolyse von ATP zu ADP. Das Substrat Rhodamin 6G (grün) wird an einem bestimmten Punkt des Zyklus gebunden und in einem folgenden Schritt wieder abgegeben.
HHU / Lutz Schmitt
Um der zunehmenden Bedrohung durch multiresistente Keime zu begegnen, ist das Verständnis der Resistenzmechanismen zentral. Eine wichtige Rolle dabei spielen Transportproteine. Ein deutsch-britisches Forschungsteam unter Leitung der Heinrich-Heine-Universität Düsseldorf (HHU) beschreibt nun in der Fachzeitschrift Nature Communications die dreidimensionale Struktur des Transportproteins Pdr5, das ähnlich auch bei humanpathogenen Pilzen vorkommt. Die Ergebnisse können helfen, Wirkmechanismen gegen gefährliche Erreger zu entwickeln.
Chemie: Veröffentlichung in Nature Communications
Für den klinischen Alltag ist die Resistenz von Mikroorganismen gegen Wirkstoffe, speziell gegen Antibiotika, ein großes Problem. Die Zahl resistenter Mikroben nimmt dabei drastisch zu. Aufgrund dessen können Infektionen inzwischen wieder für Menschen lebensbedrohlich werden, die bereits mit modernen Medikamenten besiegt schienen. Die Situation wird weiter dadurch kompliziert, dass vermehrt multiresistente Keime auftreten, die gleich vor mehreren Antibiotika oder anderen Wirkstoffen gefeit sind.
Die Forschung untersucht die Mechanismen, mithilfe derer sich Mikroben gegen die für sie giftigen Stoffe wappnen. Unter anderem transportieren sie die Giftstoffe aktiv aus der Zelle heraus, bevor sie Schaden anrichten können. Sie nutzen dazu spezielle Membrantransportproteine. Insbesondere in eukaryotischen Mikroben – solchen mit einem Zellkern, im Gegensatz zu den Bakterien, die keinen Zellkern besitzen – wie Pilzen gehören diese Membranproteine der Familie der ABC-Transporter („ATP binding cassette“) an; sie exportieren die Giftstoffe, indem sie den zellulären Energieträger ATP aufspalten.
Ein deutsch-britisches Forschungsteam unter der Leitung von Prof. Dr. Lutz Schmitt vom Institut für Biochemie der HHU stellt in einer aktuellen Publikation in Nature Communications die dreidimensionale Struktur des ABC-Transporters Pdr5 aus einem Pilz in mehreren funktionalen Zustände vor. Sie bestimmten diese Strukturen mithilfe der Einzelpartikel-Kryoelektronenmikroskopie, mit der insbesondere biologische Moleküle mit höchster Auflösung und in ihrer natürlichen Form untersucht werden können, indem sie auf tiefe Temperaturen schockgefroren werden.
Das Forschungsteam zeigte, dass Pdr5 nicht nur ein zentrales Transportprotein ist, durch das die Membranprotein-vermittelten Resistenzen bewirkt wird. Anhand der aufgelösten Strukturen konnte sowohl die Substratbindestelle lokalisiert als auch der Transportzyklus definiert werden.
Pdr5 stellt seit mehr als 30 Jahren das Modellsystem für PDR-Proteine aus humanpathogenen Pilzen – wie etwa Candida albicans, das Candidiasis verursacht – dar. Die neuen Ergebnisse helfen zu erklären, was auf molekularer Ebene ein einziges Membranprotein befähigt, viele strukturell unterschiedliche Moleküle effizient am Eintritt in die Zelle zu hindern bzw. effizient aus der Zelle herauszutransportieren. Auf dieser Grundlage kann nun begonnen werden, gezielt neue Wirkstoffe zu designen, die den Resistenzen entgegenwirken.
Seit fast 20 Jahren forscht die Arbeitsgruppe von Prof Schmitt daran, die Wirkungsweise des Transportproteins aufzuklären. Die Strukturaufklärung gelang durch gemeinsame Arbeit mit der Gruppe um Prof. Dr. Ben Luisi vom Department of Biochemistry der Universität Cambridge. Ebenfalls an der HHU beteiligt waren die Arbeitsgruppe um Prof. Dr. Holger Gohlke vom Institut für Medizinische und Pharmazeutische Chemie und das Center for Structural Studies (Leitung Dr. Sander Smits).
Originalpublikation:
Andrzej Harris, Manuel Wagner, Dijun Du, Stefanie Raschka, Lea-Marie Nentwig, Holger Gohlke, Sander H. J. Smits, Ben F. Luisi & Lutz Schmitt, Structure and efflux mechanism of the yeast pleiotropic drug resistance transporter Pdr5, Nature Communications (2021)12:5254.
DOI: 10.1038/s41467-021-25574-8
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Sensoren für „Ladezustand“ biologischer Zellen
Ein Team um den Pflanzenbiotechnologen Prof. Dr. Markus Schwarzländer von der Universität Münster und den Biochemiker Prof. Dr. Bruce Morgan von der Universität des Saarlandes hat Biosensoren entwickelt, mit denen…

Organoide, Innovation und Hoffnung
Transformation der Therapie von Bauchspeicheldrüsenkrebs. Bauchspeicheldrüsenkrebs (Pankreaskarzinom) bleibt eine der schwierigsten Krebsarten, die es zu behandeln gilt, was weltweite Bemühungen zur Erforschung neuer therapeutischer Ansätze anspornt. Eine solche bahnbrechende Initiative…

Leuchtende Zellkerne geben Schlüsselgene preis
Bonner Forscher zeigen, wie Gene, die für Krankheiten relevant sind, leichter identifiziert werden können. Die Identifizierung von Genen, die an der Entstehung von Krankheiten beteiligt sind, ist eine der großen…



