Wie visuelle Informationen von der Netzhaut ins Mittelhirn gelangen
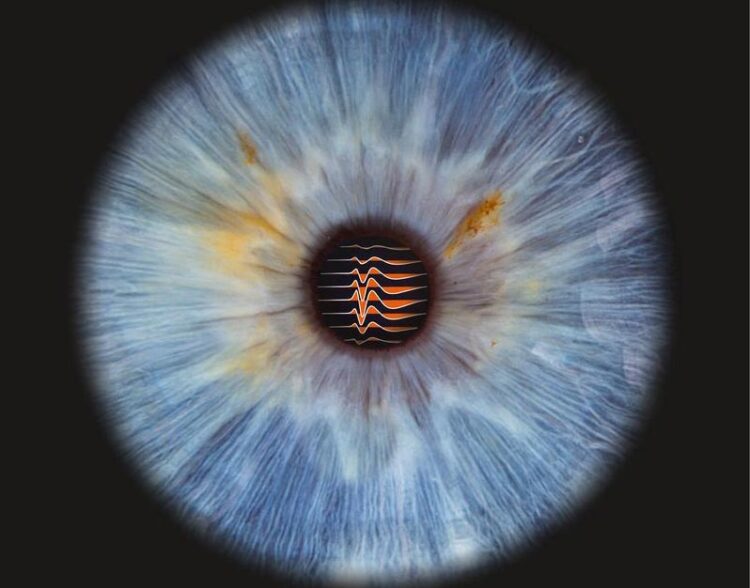
Von der Netzhaut zum Mittelhirn: elektrische Signale der axonalen Verzweigungen einer retinalen Nervenzelle, die zeitgleich an den winzigen Elektroden einer Neuropixels-Sonde im Mittelhirn gemessen wurden (hier dargestellt als Linien).
© Charité | Jens Kremkow & Fotostudio Farbtonwerk | Bernhardt Link
Neue Technologie ‚Neuropixels‘ führt zum Nachweis mosaikartiger Verbindungen.
Neurowissenschaftler:innen der Charité – Universitätsmedizin Berlin und des Max-Planck-Instituts für biologische Intelligenz (in Gründung) zeigen erstmals, wie sensorische Nervenzellen in der Netzhaut präzise mit Nervenzellen der Colliculi superiores, einer Struktur im Mittelhirn, verbunden sind. Neuropixels-Sonden sind eine noch junge Elektrodengeneration mit besonders vielen Aufzeichnungspunkten für die elektrische Aktivität von Nervenzellen. Ihr Einsatz hat die neuen Einsichten in neuronale Schaltkreise möglich gemacht und führt zum Nachweis mosaikartiger Verbindungen. Im Journal Nature Communications* beschreiben die Forschenden ein Grundprinzip im Sehsystem von Säugetieren und Vögeln.
Zwei Hirnstrukturen sind maßgeblich für die Verarbeitung von visuellen Reizen verantwortlich: die Sehrinde, der visuelle Cortex, im Großhirn und die Colliculi superiores, eine Region im Mittelhirn. Der Vorgang des Sehens und die Verarbeitung dieser Informationen sind äußerst komplex. Vereinfacht betrachtet, ist der visuelle Cortex für die generelle visuelle Wahrnehmung zuständig, die Strukturen im evolutionär älteren Mittelhirn eher für reflexartiges visuelles Verhalten. Die Mechanismen und zugrunde liegenden Prinzipien der visuellen Verarbeitung in der Sehrinde sind gut bekannt. Auch Arbeiten eines Forschungsteams um Dr. Jens Kremkow konnten dazu beitragen. Diese mündeten 2017 in der Gründung einer Emmy Noether-Nachwuchsgruppe am Neurowissenschaftlichen Forschungszentrum (NWFZ) der Charité, gefördert durch die Deutsche Forschungsgemeinschaft (DFG). Ein wesentliches Ziel der Neurowissenschaftler:innen: die neuronalen Verbindungen, die Verschaltungen, der Nervenzellen des Sehsystems noch besser zu verstehen. So sind beispielsweise viele Fragen dazu offen, wie im Einzelnen visuelle Informationen im Mittelhirn, in den Colliculi superiores, verarbeitet werden.
Retinale Ganglienzellen, sensorische Nervenzellen in der Retina, der Netzhaut des Auges, reagieren auf optische Reize aus der Umwelt und senden die Informationen zum Gehirn. Auch das Mittelhirn erhält hierbei visuelle Informationen durch direkte Signaleingänge von retinalen Nervenzellen. „Wie dabei verschiedene Nervenzellen der Retina und Nervenzellen im Mittelhirn funktional verbunden sind, lag weitgehend im Dunklen. Ebenso wenig wusste man darüber, wie die Neurone, die Nervenzellen, in den Colliculi superiores die synaptischen Eingänge verarbeiten“, sagt Studienleiter Dr. Kremkow. „Um die Mechanismen der visuellen Verarbeitung im Mittelhirn zu verstehen, sind diese Informationen essenziell.“ Bisher war es schlichtweg nicht möglich, die Aktivität von synaptisch verbundenen Nervenzellen der Retina und Neuronen des Mittelhirns im lebenden Organismus zu messen. Für die aktuellen Untersuchungen hat das Forschungsteam daher eine Methode entwickelt, die auf Messungen neuartiger, hochdichter Elektroden, sogenannter Neuropixels-Sonden, basiert. Diese Elektroden, genauer Elektrodenarrays, sind winzig klein und versammeln rund eintausend Aufzeichnungsstellen auf einem dünnen Schaft. Sie erlauben es, die elektrische Aktivität zwischen Neuronen im Gehirn gleichzeitig mit 384 Elektroden zu messen und verändern das neurowissenschaftliche Forschungsfeld derzeit deutlich.
Die Wissenschaftler:innen an der Charité und am Max-Planck-Institut für biologische Intelligenz haben die neue Technologie nun eingesetzt, um die elektrische Aktivität in den jeweiligen Mittelhirnstrukturen von Maus (Colliculi superiores) und Vogel (Optic tectum) zu ermitteln. Diese Hirnstrukturen haben einen gemeinsamen evolutionären Ursprung und spielen in beiden Arten eine wichtige Rolle bei der visuellen Verarbeitung von eingehenden Signalen aus der Retina. Während der Untersuchungen machen die Forschenden eine überraschende Entdeckung: „Für gewöhnlich werden bei diesen elektrophysiologischen Ableitungen elektrische Signale jener Aktionspotenziale gemessen, die am Soma, dem Zellkörper von Nervenzellen entstehen“, erklärt Dr. Kremkow. „Bei unseren Ableitungen sind uns allerdings Signale aufgefallen, die anders als die bekannten Aktionspotenziale aussahen. Wir sind der Ursache auf den Grund gegangen. Wie sich dabei herausgestellt hat, gehen diese im Mittelhirn eingehenden Signale auf Aktionspotenziale in den sogenannten axonalen Verzweigungen der retinalen Ganglienzellen zurück. Demnach ist es möglich, die elektrischen Signale von Axonen, den signalgebenden Fortsätzen der Nervenzellen, mittels der neuartigen Elektrodenarrays abzuleiten. Das ist eine völlig neue Erkenntnis.“ Dem Team um Dr. Kremkow ist es auf diese Weise erstmalig gelungen, die Aktivität von Nervenzellen in der Retina und von Signalempfängern im Mittelhirn zeitgleich zu messen.
Die funktionelle Verbindung der Nervenbahnen zwischen Auge und Mittelhirn war bislang eine Unbekannte. Jetzt konnten die Forschenden einzelzellgenau aufzeigen, dass die räumliche Anordnung der Eingänge von Signalen der retinalen Ganglienzellen im Mittelhirn exakt die Anordnung in der Retina widerspiegelt. „Die räumliche Anordnung der Retina wird quasi eins zu eins in den Strukturen des Mittelhirns übernommen“, so der Hirnforscher Dr. Kremkow. „Neu war für uns ebenfalls, dass die Neurone im Mittelhirn einen sehr starken und spezifischen synaptischen Eingang von den retinalen Ganglienzellen erhalten, allerdings nur von ein paar wenigen dieser sensorischen Nervenzellen. Diese Verschaltung ermöglicht eine sehr strukturierte und funktionale Verbindung zwischen der Netzhaut des Auges und den entsprechenden Regionen des Mittelhirns.“ Eine Erkenntnis, die unter anderem zu einem besseren Verständnis des sogenannten Blindsehens, auch Blindsight, beiträgt. Hierbei handelt es sich um ein Phänomen, das beim Ausfall der primären Sehrinde, beispielsweise durch eine Hirnverletzung oder Tumoren, beobachtet wird. Während in diesem Fall eine bewusste visuelle Wahrnehmung nicht mehr möglich ist, verbleibt eine Restfunktion der visuellen Informationsverarbeitung, eine intuitive Wahrnehmung von Reizen, Umrissen, Bewegungen oder auch Farben, die offenbar auf das Mittelhirn zurückgeht.
Um zu prüfen, ob die Prinzipien, die zunächst am Mausmodell beobachtet wurden, auch für andere Wirbeltiere gelten – und somit von genereller Natur sein könnten, hat die Gruppe um Dr. Kremkow mit einem Team am Max-Planck-Institut für biologische Intelligenz zusammengearbeitet. Dr. Daniela Vallentin leitet dort eine Lise-Meitner-Forschungsgruppe und ist maßgeblich mit neuronalen Schaltkreisen befasst, die für die Koordination präziser motorischer Bewegungen bei Vögeln verantwortlich sind. „Wir konnten mit den gleichen Messungen zeigen, dass die Nervenbahnen, die Netzhaut und Mittelhirn verbinden, bei Zebrafinken nach einem ähnlichen Prinzip aufgebaut sind“, sagt Dr. Vallentin. „Dies ist insofern überraschend, da die optische Auflösung bei Vögeln deutlich höher ist und in der Evolution zwischen Vögeln und Säugetieren viel Zeit vergangen ist.“ Die Anordnung und funktionale Verschaltung der retinalen Ganglienzellen ähneln sich den Beobachtungen zufolge im Optischen Tectum und in den Colliculi superiores. Die Forschenden schließen daraus, dass die gefundenen Prinzipien essenziel für die visuelle Verarbeitung im Mittelhirn von Wirbeltieren sind. Wahrscheinlich handelt es sich sogar um universelle Prinzipien im Aufbau des Wirbeltiergehirns, also auch des menschlichen Gehirns.
„Nachdem wir die funktionale, mosaikartige Verschaltung zwischen den retinalen Ganglienzellen und den Neuronen der Colliculi superiores verstanden haben, werden wir nun weiter herausarbeiten, wie die sensorischen Signale im Sehsystem, speziell den Regionen im Mittelhirn, weiterverarbeitet werden und wie sie zu reflexartigem visuellen Verhalten beitragen“, blickt Dr. Kremkow in die Zukunft. Auch möchte das Team herausfinden, ob sich die neue Methode in anderen Gehirnstrukturen anwenden lässt und die Aktivität der Axone andernorts ebenfalls messbar ist. Sollte das der Fall sein, könnten sich zahlreiche neue Möglichkeiten eröffnen, um den Mechanismen des Gehirns auf die Spur zu kommen.
Wissenschaftliche Ansprechpartner:
Dr. Jens Kremkow
Neurowissenschaftliches Forschungszentrum
Charité – Universitätsmedizin Berlin
t: +49 30 450 639 081
Email: jens.kremkow@charite.de
Originalpublikation:
*Sibille J et al. High-density electrode recordings reveal strong and specific connections between retinal ganglion cells and midbrain neurons. Nat Comm 2022 Sep 5. doi: 10.1038/s41467-022-32775-2
Weitere Informationen:
https://www.nature.com/articles/s41467-022-32775-2
https://nwfz.charite.de
https://kremkowlab.com/
https://www.charite.de/service/pressemitteilung/artikel/detail/emmy_noether_nach…
https://www.bi.mpg.de/vallentin/de
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Sensoren für „Ladezustand“ biologischer Zellen
Ein Team um den Pflanzenbiotechnologen Prof. Dr. Markus Schwarzländer von der Universität Münster und den Biochemiker Prof. Dr. Bruce Morgan von der Universität des Saarlandes hat Biosensoren entwickelt, mit denen…

Organoide, Innovation und Hoffnung
Transformation der Therapie von Bauchspeicheldrüsenkrebs. Bauchspeicheldrüsenkrebs (Pankreaskarzinom) bleibt eine der schwierigsten Krebsarten, die es zu behandeln gilt, was weltweite Bemühungen zur Erforschung neuer therapeutischer Ansätze anspornt. Eine solche bahnbrechende Initiative…

Leuchtende Zellkerne geben Schlüsselgene preis
Bonner Forscher zeigen, wie Gene, die für Krankheiten relevant sind, leichter identifiziert werden können. Die Identifizierung von Genen, die an der Entstehung von Krankheiten beteiligt sind, ist eine der großen…



