Wirkmechanismus des Hepatitis B- und D-Virus-Zelleintrittsinhibitors Bulevirtide entschlüsselt
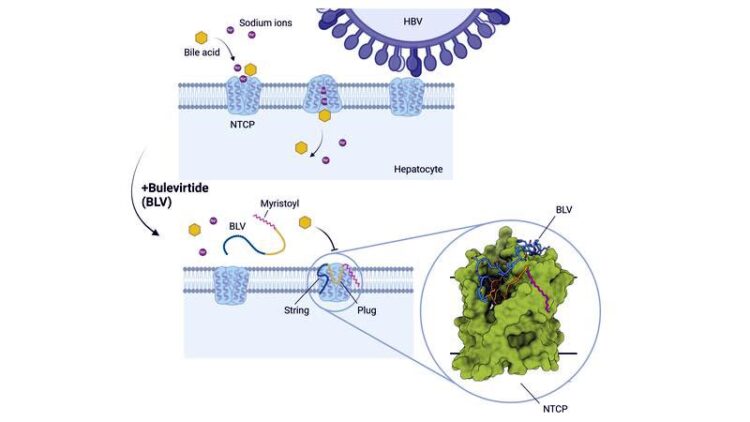
Schematische Darstellung der molekularen Blockade des Rezeptormoleküls NTCP durch Bulevirtide (BLV). Die Abbildung wurde mit BioRender.com erstellt.
(c) DZIF/Universität Heidelberg
Über 12 Millionen Menschen weltweit sind chronisch mit dem Hepatitis D-Virus (HDV) infiziert. HDV nutzt die Oberflächenproteine des Hepatitis B-Virus (HBV) als Vehikel, um spezifisch über ein Transporterprotein in der Membran von Leberzellen in die Zellen zu gelangen. Dieser Zelleintritt kann durch den unter dem Namen Hepcludex als Medikament zugelassenen Wirkstoff Bulevirtide verhindert werden. Einem internationalen Forschungsteam ist es nun gelungen, die molekulare Struktur von Bulevirtide im Komplex mit dem HBV/HDV-Rezeptor NTCP auf molekularer Ebene zu entschlüsseln.
Eine chronische Infektion mit dem Hepatitis-D-Virus – die schwerste virale Lebererkrankung – ist verbunden mit einem hohen Risiko, an Leberzirrhose und Leberkrebs zu versterben. Ausgelöst wird sie durch das Hepatitis D-Virus (HDV), welches die Oberflächenproteine des Hepatitis B-Virus (HBV) als Vehikel nutzt, um spezifisch über ein Protein in der Membran von Leberzellen – das Gallensalz-Transporterprotein NTCP – in die Zellen zu gelangen. Dieser Zelleintritt kann durch den Wirkstoff Bulevirtide verhindert werden. Einem internationalen Forschungsteam ist es nun gelungen, die molekulare Struktur von Bulevirtide im Komplex mit dem HBV/HDV-Rezeptor NTCP auf molekularer Ebene zu entschlüsseln. Die in der renommierten Fachzeitschrift Nature Communications veröffentlichten Forschungsergebnisse ebnen den Weg zu gezielteren und effektiveren Behandlungen für Millionen chronisch HBV/HDV-Infizierter.
Der Eintrittsinhibitor Bulevirtide ist das erste und derzeit einzige zugelassene Medikament (unter dem Namen Hepcludex) zur Behandlung chronischer Infektionen mit dem Hepatitis D-Virus. Der Wirkstoff hemmt effektiv die Vermehrung von Hepatitis D-Viren und führt zu einer deutlichen Verbesserung der Leberfunktion. Der genaue Mechanismus, mit dem Bulevirtide mit dem Eintrittsrezeptor der Viren auf der Oberfläche der Leberzellen – dem Gallensalz-Transporterprotein NTCP (kurz für: Natriumtaurocholat-kotransportierende Polypeptid) – interagiert und dadurch den Eintritt der Viren in die Zellen inhibiert, war bisher allerdings noch unbekannt.
Um die molekulare Interaktion von Bulevirtide und NTCP auf molekularer Ebene zu verstehen, generierten die Forschenden zunächst ein Antikörperfragment, welches spezifisch den NTCP-Bulevirtide-Komplex erkennt und diesen an Nanopartikel gebunden einer Analyse zugänglich macht. Anschließend wurde dieser Komplex mittels Cryo-Elektronenmikroskopie untersucht, wodurch strukturelle Details mit atomarer Auflösung sichtbar gemacht werden konnten. Die Forschungsergebnisse stellen einen Meilenstein dar im Verständnis sowohl der Interaktion von HBV und HDV mit ihrem zellulären Eintrittsrezeptor NTCP als auch des Mechanismus der Zellrezeptorblockade durch Bulevirtide.
Wie Bulevirtide den Zelleintrittsrezeptor NTCP blockiert
Die Analyse zeigte, dass Bulevirtide in der Interaktion mit dem HBV/HDV-Rezeptor NTCP drei funktionelle Domänen bildet: eine Myristoylgruppe, die auf der Zell-Außenseite mit der Zellmembran interagiert; eine essenzielle Kernsequenz („plug“), die sich exakt in den Gallensalztransporttunnel des NTCP wie der Bart eines Schlüssels in ein Schloss einfügt; und eine Aminosäurekette, die sich über die extrazelluläre Oberfläche des Rezeptors erstreckt und diesen wie eine Klammer umschließt.
„Die Ausbildung eines ‚plugs‘ im Transporttunnel und die damit verbundene Inaktivierung des Gallensalztransporters ist bislang einzigartig unter allen bekannten Virus-Rezeptor-Komplexen. Diese Struktur erklärt, warum die physiologische Funktion des NTCP bei der Behandlung von Patienten und Patientinnen mit Bulevirtide gehemmt wird“, sagt Prof. Stephan Urban, DZIF-Professor für „Translationale Virologie“ und stellvertretender Koordinator des DZIF-Forschungsbereichs Hepatitis, in dessen Labor am Universitätsklinikum Heidelberg der Wirkstoff Bulevirtide entwickelt wurde.
„Mit den strukturellen Details der Interaktion mit Bulevirtide haben wir auch Erkenntnisse gewonnen, welche die Entwicklung kleinerer Wirkstoffe – sogenannter Peptidomimetika – mit verbesserten pharmakologischen Eigenschaften ermöglichen. Unsere Strukturanalyse legt zudem einen Grundstein für die Entwicklung von Medikamenten, die nicht nur auf Peptiden basieren und möglicherweise eine orale Verabreichung ermöglichen“, fügt der Mitautor der Studie, Prof. Joachim Geyer vom Institut für Pharmakologie und Toxikologie der Justus-Liebig-Universität Gießen, hinzu.
Evolutionäre Anpassung von Hepatitis B-Viren an Wirtsspezies
Die Strukturanalyse entschlüsselte auch einen wichtigen Faktor der Speziesspezifität der Hepatitis B- und D-Viren. Demnach spielt die Aminosäure an Position 158 der NTCP-Peptidkette eine essenzielle Rolle in der Virus-Rezeptor-Interaktion. Eine Änderung der Aminosäure an dieser Position verhindert die Bindung von HBV/HDV. Dies erklärt, warum bestimmte Altwelt-Primaten, wie zum Beispiel Makaken, von HBV/HDV nicht infiziert werden können.
„Unsere Erkenntnisse ermöglichen ein tieferes Verständnis der evolutionären Anpassung von menschlichen und tierischen Hepatitis B-Viren an ihre Wirte und liefern darüber hinaus wichtige molekulare Grundlagen für die Entwicklung neuer und zielgerichteter Medikamente“, ergänzt Mitautor Prof. Dieter Glebe, DZIF-Wissenschaftler am Institut für Medizinische Virologie der Justus-Liebig-Universität Gießen.
„Unsere Untersuchungsergebnisse sind ein wichtiger Schritt im Kampf gegen Hepatitis D und B. Durch das Verständnis der Struktur von Bulevirtide und seiner Bindung an NTCP können wir potenziell gezieltere und effektivere Behandlungen für Millionen chronisch HBV/HDV-Infizierter entwickeln“, fasst Prof. Kaspar Locher, Letztautor der Publikation und Leiter des international renommierten Strukturbiologenteams an der ETH Zürich, die Forschungsresultate zusammen.
Wissenschaftliche Ansprechpartner:
Prof. Dr. Dieter Glebe
Justus-Liebig-Universität Gießen
dieter.glebe@viro.med.uni-giessen.de
Prof. Dr. Stephan Urban
Universität Heidelberg
dzifheidelberg.HYG@med.uni-heidelberg.de
Originalpublikation:
Liu H. et al.: Structure of antiviral drug bulevirtide bound to hepatitis B and D virus receptor protein NTCP, Nat Commun, 2024, DOI: https://doi.org/10.1038/s41467-024-46706-w
Weitere Informationen:
https://www.dzif.de/de/wirkmechanismus-des-hepatitis-b-und-d-virus-zelleintritts… Pressemitteilung des Deutschen Zentrums für Infektionsforschung (DZIF)
Media Contact
Alle Nachrichten aus der Kategorie: Biowissenschaften Chemie
Der innovations-report bietet im Bereich der "Life Sciences" Berichte und Artikel über Anwendungen und wissenschaftliche Erkenntnisse der modernen Biologie, der Chemie und der Humanmedizin.
Unter anderem finden Sie Wissenswertes aus den Teilbereichen: Bakteriologie, Biochemie, Bionik, Bioinformatik, Biophysik, Biotechnologie, Genetik, Geobotanik, Humanbiologie, Meeresbiologie, Mikrobiologie, Molekularbiologie, Zellbiologie, Zoologie, Bioanorganische Chemie, Mikrochemie und Umweltchemie.
Neueste Beiträge

Ist der Abrieb von Offshore-Windfarmen schädlich für Miesmuscheln?
Rotorblätter von Offshore-Windparkanlagen unterliegen nach mehrjährigem Betrieb unter rauen Wetterbedingungen einer Degradation und Oberflächenerosion, was zu erheblichen Partikelemissionen in die Umwelt führt. Ein Forschungsteam unter Leitung des Alfred-Wegener-Instituts hat jetzt…
Per Tierwohl-Tracker auf der Spur von Krankheiten und Katastrophen
DBU-Förderung für Münchner Startup Talos… Aus dem Verhalten der Tiere können Menschen vieles lernen – um diese Daten optimal auslesen zu können, hat das Münchner Startup Talos GmbH wenige Zentimeter…

Mit Wearables die Gesundheit immer im Blick
Wearables wie Smartwatches oder Sensorringe sind bereits fester Bestandteil unseres Alltags und beliebte Geschenke zu Weihnachten. Sie tracken unseren Puls, unsere Schrittzahl oder auch unseren Schlafrhythmus. Auf welche Weise können…



