Molekül gegen HIV: kleine Änderung, große Wirkung
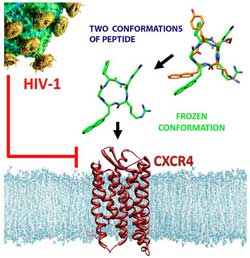
Perfekte Passform: Das abgewandelte anti-HIV-Molekül (Mitte) bindet mit hoher Affinität an den CXCR4-Rezeptor auf der Oberfläche von Immunzellen.<br><br>Copyright: Wiley-VCH Verlag GmbH & Co. KGaA, genehmigte Veröffentlichung<br>
Obwohl sie die Form eines bereits bekannten synthetischen Anti-HIV-Moleküls nur leicht veränderten, erzielten sie eine große Wirkung: Das neue Mini-Protein dockt besser an CXCR4-Rezeptoren auf der Oberfläche von Immunzellen an, einem bevorzugten Angriffspunkt für häufig vorkommende HIV-Varianten.
Damit ist dem Aids-Erreger der Eintritt in die Zellen verwehrt, die Viren können sich nicht weiter im Organismus ausbreiten. Diese Resultate wurden kürzlich in der internationalen Ausgabe des Fachmagazins „Angewandte Chemie“ veröffentlicht.
Die unterschiedlichen Erreger des HIV-1-Virenstammes verschaffen sich Zugang zu den Immunzellen, indem sie an die Zell-Rezeptoren CCR5 oder CXCR4 andocken. An diese Bindungsstellen heften sich üblicherweise körpereigene Botenstoffe, so genannte Chemokine. Während es bereits ein CCR5-spezifisches HIV-Medikament gibt, ist für CXCR4 bisher kein Arzneimittel zugelassen. Da das neue, ringförmige Peptid – ein Mini-Protein – den CXCR4-Rezeptor für das Virus blockiert, könnte es sich als ein interessanter Wirkstoff-Kandidat gegen HIV und AIDS erweisen.
Das Forschungsprojekt wurde von Wissenschaftlern vom Lehrstuhl für Pharmazeutische Radiochemie und am Institute for Advanced Study der TUM initiiert und gemeinsam mit Molekularbiologen der Universität Neapel und Virologen des Helmholtz Zentrum München durchgeführt. Die TUM-Wissenschaftler um Prof. Dr. Hans-Jürgen Wester und Prof. Dr. Dr. h.c. Horst Kessler hatten ursprünglich an einem neuen Bildgebungs-Verfahren für Tumore gearbeitet. Dafür nutzten sie ringförmige Proteinschnipsel, die sie veränderten, um ihre spezifische Bindung an den CXCR4-Rezeptor zu erhöhen. Dabei erkannten sie, dass diese Methode auch ein enormes Potenzial für die Arzneimittelforschung birgt.
Die Wissenschaftler bauten das Peptid mit einem einfachen Trick um: Sie verschoben eine Aminosäuren-Seitenkette von Kohlenstoff zu einem benachbarten Stickstoff-Atom. So veränderten sie die Grundstruktur des Moleküls zwar nur geringfügig – seine biologischen Eigenschaften dafür umso mehr: Die Bindungsgruppen des Peptids befinden sich jetzt in einer optimalen Stellung, um an den CXCR4-Rezeptor anzudocken. Damit bindet das Peptid 400- bis 1.500-mal besser an CXCR4 als bisher bekannte andere Verbindungen, die derzeit als Wirkstoffe getestet werden.
Zudem weist das künstliche Peptid Merkmale auf, die seinen Einsatz im Organismus begünstigen. Sein besonderer chemischer Aufbau schützt das ringförmige Molekül vor der Zerstörung durch körpereigene Enzyme. Da CXCR4-Rezeptoren auch eine wichtige Rolle bei der Entstehung von Krebsmetastasen spielen, benutzen die Münchner Forscher eine abgewandelte Form dieses Moleküls bereits für die Bildgebung von Tumoren.
„Wir freuen uns, dass wir mit unserem neues Peptid-Design einen Wirkstoff entwickelt haben, den wir für die Therapie lebensbedrohender Krankheiten anwenden können“, sagt Prof. Horst Kessler, ein Senior Fellow im TUM Institute for Advanced Study und „Emeritus of Excellence“ in der Fakultät für Chemie. „Das Molekül könnte eine wirksame Waffe gegen besonders aggressive HIV-1-Stämme sein. Diese Viren finden wir häufig bei Patienten, die seit langer Zeit HIV-infiziert sind“, ergänzt Prof. Ruth Brack-Werner, Virologin am Helmholtz Zentrum München. „Verbindungen dieser Art bieten ungeahnte Möglichkeiten für die Entwicklung neuer Medikamente“, erklärt Prof. Hans-Jürgen Wester, Leiter des Lehrstuhls für Pharmazeutische Radiochemie. „Wir warten daher mit großer Spannung auf die ersten präklinischen und klinischen Tests.“
Die Forschungsarbeit wurde von der Exzellenzinitiative des Bundes und der Länder (TUM-IAS, Center of Integrated Protein Research Munich), der Deutschen Forschungsgemeinschaft (DFG SFB 824, Unterprojekt B5) und dem Helmholtz Zentrum München unterstützt.
Originalpublikation:
A Conformationally Frozen Peptoid Boosts CXCR4 Affinity and Anti-HIV Activity. Oliver Demmer, Andreas O. Frank, Franz Hagn, Margret Schottelius, Luciana Marinelli, Sandro Cosconati, Ruth Brack-Werner, Stephan Kremb, Hans-Jürgen Wester, and Horst Kessler. Angewandte Chemie Int. Ed. 2012, 51, 8110-8113, DOI: 10.1002/anie.201202090
Kontakt:
Prof. Dr. Horst Kessler
TUM Institute for Advanced Study / Fakultät für Chemie
Technische Universität München
Lichtenbergstr. 4
85747 Garching, Germany
Tel.: +49 89 289-13300
Fax.: +49 89 289-13210
E-Mail: kessler@tum.de
Media Contact
Weitere Informationen:
http://www.org.chemie.tu-muenchen.deAlle Nachrichten aus der Kategorie: Medizin Gesundheit
Dieser Fachbereich fasst die Vielzahl der medizinischen Fachrichtungen aus dem Bereich der Humanmedizin zusammen.
Unter anderem finden Sie hier Berichte aus den Teilbereichen: Anästhesiologie, Anatomie, Chirurgie, Humangenetik, Hygiene und Umweltmedizin, Innere Medizin, Neurologie, Pharmakologie, Physiologie, Urologie oder Zahnmedizin.
Neueste Beiträge
Menschen vs Maschinen – Wer ist besser in der Spracherkennung?
Sind Menschen oder Maschinen besser in der Spracherkennung? Eine neue Studie zeigt, dass aktuelle automatische Spracherkennungssysteme (ASR) unter lauten Bedingungen eine bemerkenswerte Genauigkeit erreichen und manchmal sogar die menschliche Leistung…

Nicht in der Übersetzung verloren: KI erhöht Genauigkeit der Gebärdenspracherkennung
Zusätzliche Daten können helfen, subtile Gesten, Handpositionen und Gesichtsausdrücke zu unterscheiden Die Komplexität der Gebärdensprachen Gebärdensprachen wurden von Nationen weltweit entwickelt, um dem lokalen Kommunikationsstil zu entsprechen, und jede Sprache…

Brechen des Eises: Gletscherschmelze verändert arktische Fjordökosysteme
Die Regionen der Arktis sind besonders anfällig für den Klimawandel. Es mangelt jedoch an umfassenden wissenschaftlichen Informationen über die dortigen Umweltveränderungen. Forscher des Helmholtz-Zentrums Hereon haben nun an Fjordsystemen anorganische…


