Licht geht ins Ohr
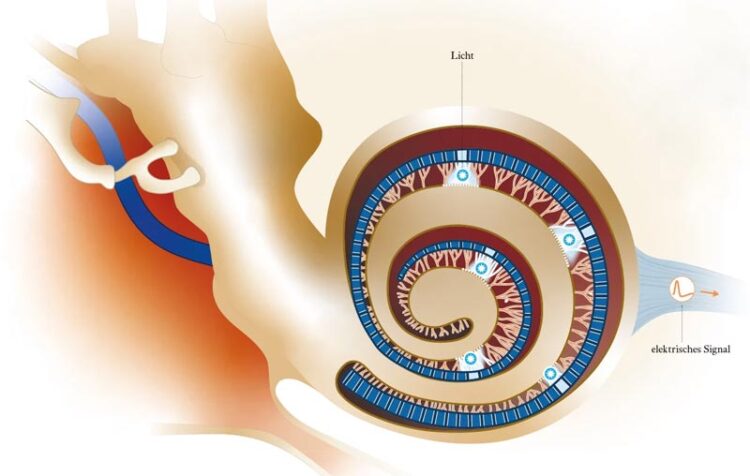
Ein optogenetisches Cochlea-Implantat übersetzt akustische Reize in Lichtpulse. Feine lichtleitende Fasern (blau) leiten die Pulse ins Innenohr: hohe Töne an die Basis, tiefere Töne weiter an die Spitze der Hörschnecke. Mit molekularen Lichtsensoren ausgestattete Nervenzellen des Hörnervs wandeln die Lichtpulse in elektrische Signale um und leiten sie zur weiteren Verarbeitung ins Gehirn.
© GCO nach Moser/ Institute for Auditory Neuroscience
Eine neue Generation von Cochlea-Implantaten soll Menschen mit Hörstörungen das Hören erleichtern.
Im Freundeskreis diskutieren, ein Konzert genießen, bei Straßenlärm telefonieren – Menschen mit Hörproblemen bleiben alltägliche Höreindrücke oft verwehrt. Tobias Moser will den Betroffenen mit einer neuen Generation von Hörhilfen neue Klangwelten zugänglich machen. Die sogenannten optischen Cochlea-Implantate sind ein Beispiel für Therapien, die auf Erkenntnissen aus der Grundlagenforschung beruhen.
Text: Catarina Pietschmann
In Deutschland leben rund 16 Millionen schwerhörige und 80 000 gehörlose Menschen. Etwa zwei von tausend Kindern werden mit einer bislang noch unheilbaren Hörstörung geboren, weitere werden in den ersten Lebensjahren schwerhörig. Wer von Geburt an wenig oder nichts hört, lernt nur mit Mühe oder überhaupt nicht sprechen und kann sich schlechter mit seinen Mitmenschen austauschen. Weniger soziale Kontakte sind die Folge.
Tobias Moser, Neurowissenschaftler und Hals-Nasen-Ohren-Arzt, leitet eine Forschungsgruppe am Max-Planck-Institut für Multidisziplinäre Naturwissenschaften in Göttingen und das Institut für Auditorische Neurowissenschaften der Universitätsmedizin Göttingen. Er ist Spezialist für die sogenannte Synapsen-Schwerhörigkeit, also für Hörstörungen im Innenohr, bei denen ein Hörgerät in der Regel wirkungslos ist. Wird bei einem Säugling eine solche Synapsen-Schwerhörigkeit festgestellt, kann ihm derzeit nur ein sogenanntes Cochlea-Implantat späteres Hören und Sprechen ermöglichen. Im Idealfall wird das Implantat im ersten Lebensjahr eingesetzt, noch bevor das Kind zu sprechen beginnt. „In den ersten Lebensjahren werden im Gehirn viele synaptische Verbindungen aus- und umgebaut“, erläutert Moser. „Wenn während dieser Phase im Gehirn zu wenige Hörreize aus den Ohren ankommen, werden viele Verbindungen nicht korrekt geknüpft. Später lässt sich dies kaum mehr kompensieren.“
Hören ist kompliziert: Schallwellen werden von der Ohrmuschel in den äußeren Gehörgang bis zum Trommelfell geleitet, wo sie von den Gehörknöchelchen Hammer, Amboss und Steigbügel des Mittelohrs aufgenommen und an das Innenohr weitergegeben werden – an die wie eine Spirale aufgewickelte Hörschnecke. „Bis hier können Störungen oft chirurgisch so gut behandelt werden, dass man noch nicht einmal ein Hörgerät braucht“, sagt Moser. Die Ursache von Schwerhörigkeit liegt jedoch in 70 Prozent aller Fälle im Innenohr oder am Hörnerv.
Übertragung ans Innenohr
Die spiralförmige Hörschnecke des Innenohrs – auch Cochlea genannt – trägt vier Reihen von Haarsinneszellen, die mit ihren Haarbündeln in den flüssigkeitsgefüllten Innenraum der Cochlea ragen. Von den Gehörknöchelchen auf die Cochlea übertragene mechanische Schwingungen versetzen das Sinnesgewebe in Bewegung. Dies verbiegt die Haarbündel der Sinneszellen um winzigste Bruchteile von Millimetern. Das reicht aus, um die Haarsinneszellen zu aktivieren. Die äußeren drei Reihen der Haarsinneszellen verstärken diese mechanischen Schwingungen bei leisen Tönen. Die innere Reihe überträgt die Schallinformation von ihren Synapsen an die Zellen des Hörnervs, welche die Information als Nervenimpuls ans Gehirn leiten. Jeder Mensch wird mit einer bestimmten Anzahl von Haarsinnes- und Hörnervenzellen geboren. Diese müssen ein Leben lang halten, denn es bilden sich keine nach. „Wahrscheinlich lassen Lärm und Alter zunächst die Haar-, dann auch die Hörnervenzellen absterben“, erklärt Moser. Wird eine Haarsinneszelle beispielsweise in einer Diskothek mit 100 Dezibel oder mehr beschallt, geht sie in der Regel zugrunde. Auch manche Antibiotika oder Krebsmedikamente können vorübergehende oder bleibende Hörschäden verursachen.
Cochlea-Implantate werden nicht nur taub geborenen Kindern, sondern zunehmend auch schwersthörigen Erwachsenen eingesetzt. Die Implantate übernehmen die Funktion der Hörschnecke und umgehen die Sinneszellen. Sie reizen die Nervenzellen des Hörnervs also direkt. Bei der Implantation werden ein Elektrodenträger mit – je nach Modell – 12 bis 24 Elektroden in die Hörschnecke geschoben und ein elektrischer Stimulator nebst Empfangsspule und Magnetkopplung hinter der Ohrmuschel im Schädelknochen platziert. Ein daran gekoppelter Sprachprozessor zerlegt Schall in seine Frequenzen und überträgt die Frequenz-, Zeit- und Lautstärkeinformation an den Stimulator. Nach dem Einsetzen elektrischer Cochlea-Implantate müssen die Patientinnen und Patienten das Hören wieder neu lernen, denn die geringe Anzahl an Elektroden schränkt die Wahrnehmung unterschiedlicher Tonhöhen stark ein. „Am Anfang sprechen viele Patienten von einem rauschigen und metallischen Klang. Sprache ist häufig schwer oder gar nicht zu verstehen“, beschreibt Moser die ersten Eindrücke nach einer Operation. „Es hört sich zum Beispiel an, wie wenn jemand hinter einer Wand spricht: Man hört, dass jemand etwas sagt, kann es aber nicht verstehen. Auch nach Monaten der Übung ist oft schwer zu erkennen, ob eine Frage gestellt oder eine Aussage gemacht wird, weil die Patienten die Sprachmelodie nicht erfassen können.“
Intensives Hörtraining erforderlich
Vor der Operation gibt es deshalb stets intensive Gespräche zwischen Patienten und Angehörigen sowie den Ärztinnen, Ingenieuren und Logopädinnen. „Wenn sich jemand nicht vorstellen kann, über ein Jahr intensiv zu üben, sollte er auf ein Implantat verzichten“, sagt Moser. Aber selbst nach intensivem Hörtraining wird es nicht wieder so sein wie früher. „Die Betroffenen werden immer Schwierigkeiten haben, Sprache in Alltagssituationen mit Hintergrundgeräuschen oder mit mehreren Gesprächspartnern zu verstehen. Auch Melodien lassen sich nur schwer erkennen.“ Vom Klangerlebnis eines Klavierkonzerts von Sergei Rachmaninow oder eines Whitney-Houston-Songs bleibt nach dem Einsetzen eines Cochlea-Implantats also nicht mehr viel übrig.
In seiner Sprechstunde in der Universitätsmedizin Göttingen spricht Tobias Moser immer wieder mit Patientinnen und Patienten, die mit dem „elektrischen Hören“ nicht zufrieden sind. Besonders Berufsmusiker verzweifeln an der Situation. Die Hoffnung des Wissenschaftlers ruht deshalb auf sogenannten optischen Cochlea-Implantaten, an denen Mosers Team seit 2007 forscht. Die Idee: Die Schallinformation wird nicht elektrisch, sondern durch Licht übertragen. Wenn es funktioniert, wäre das ein Meilenstein. Der Klang von Sprache und Musik könnte dadurch sehr viel natürlicher und nuancenreicher werden.
Den Grundstein dieser Technik haben Forschende in den 1970er-Jahren am Max-Planck-Institut für Biochemie in Martinsried gelegt. Dieter Oesterhelt und sein Team haben damals in der Zellmembran von Bakterien Ionenpumpen entdeckt, die von Licht aktiviert werden. Um die Jahrtausendwende fanden Peter Hegemann von der Universität Regensburg (heute: Humboldt-Universität zu Berlin) gemeinsam mit Georg Nagel (jetzt: Universität Würzburg) und Ernst Bamberg am Max-Planck-Institut für Biophysik in Frankfurt lichtempfindliche Ionenkanäle in Grünalgen. Diese Kanäle bilden die Basis für das neue Forschungsfeld der Optogenetik, das Wissenschaftlern dabei hilft, die Funktionsweise von Zellen und Organen zu entschlüsseln. Insbesondere die Neurowissenschaften nutzen die Optogenetik.
Nervenzellen sind ja außerhalb des Auges lichtunempfindlich. Damit man sie mit Licht aktivieren kann, müssen die Zellen also erst einmal mit einem entsprechenden Sensor ausgestattet werden. Dazu dienen die ursprünglich aus Algenzellen stammenden, lichtempfindlichen Ionenkanäle. Zunächst bringen die Forschenden den genetischen Bauplan dieser Proteine mittels Gentherapie in die Nervenzellen des Hörnervs ein. Als Genfähre dienen harmlose, vermehrungsunfähige Viren, welche ausschließlich an die Nervenzellen im Hörnerv binden und das Gen für das Kanalprotein im Zellkern der Nervenzelle platzieren. Die Nervenzellen bauen den Lichtsensor dann in ihre Membran ein. Sobald er Licht erhält, öffnet er seine Schleusen, Ionen strömen ein, und die Zelle wird elektrisch aktiv.
Wie beim herkömmlichen elektrischen Cochlea-Implantat wird der Schall in Frequenzbänder zerlegt, nun aber in viel mehr und feinere: 64 den Frequenzbändern zugeordnete Lichtleiter leiten Licht ins Innenohr – hohe Frequenzen an die Basis der Cochlea, niedrige immer weiter die Windungen der Schnecke entlang bis zu deren Spitze. „Das Gehirn weiß, dass aktive Nervenzellen an der Basis der Cochlea hohe Töne bedeuten, aktive Zellen am Ende für ein tiefes Brummen stehen. Wir müssen also nur dafür sorgen, dass die Lichtleiter zu den richtigen Stellen an der Cochlea führen und die zum Ton passenden Nervenzellen aktivieren“, erklärt Moser. Die Implantate vermitteln so selbst dann einen Höreindruck, wenn keine Sinneszellen mehr intakt sind.
Tonhöhen lassen sich gut unterscheiden
Erste Tests mit Computersimulationen und Nagetieren zeigen, dass die Technik funktioniert. Für schwache und mittlere Lautstärken ist die Unterscheidung von Tonhöhen vom normalen Hören kaum zu unterscheiden. Mosers Team will die neuen Implantate nun am Göttinger Primatenzentrum an Weißbüschelaffen testen. Die Tiere sind echte Plaudertaschen und in dieser Hinsicht dem Menschen sehr ähnlich. Die Forschenden machen sich das zunutze, indem sie den Affen aus einem Lautsprecher derzeit Rufe vorspielen, die nur so viele Frequenzen besitzen wie ein optisches Cochlea-Implantat. „Die Tiere erkennen die Rufe trotz der wenigen Frequenzen und antworten darauf. Das lässt darauf schließen, dass die neuen Implantate auch unsere Sprache verständlich transportieren könnten“, so Moser. Als Nächstes wollen die Forschenden um den Göttinger Nachwuchsgruppenleiter Marcus Jeschke den Affen optische Cochlea-Implantate einsetzen und herausfinden, ob sie die Rufe ihrer Artgenossen dann immer noch erkennen.
Bevor 2026 die erste klinische Studie am Menschen beginnen kann, müssen Moser und sein Team noch an der Technik feilen. Der Energieverbrauch der Implantate darf nicht zu hoch sein, und die Zeit- und Frequenzauflösung sollen optimiert werden. Einen wird der Start der Studie besonders freuen, auch wenn er selbst nicht daran teilnehmen kann: Fadhel El May ist Doktorand bei Tobias Moser. Von Geburt an schwerhörig, trug er als Kind zunächst klassische Hörgeräte. Im Alter von sechzehn Jahren bekam er dann ein elektrisches Cochlea-Implantat in ein Ohr.
Wie hat sich sein Leben durch dieses Implantat verändert? „Anfangs war ich erschrocken, wie wenig ich verstand. Es dauerte sechs Monate, bis mein Gehirn es geschafft hat, Sprache zu verstehen. Wenn ich heute das Implantat ausschalte, hab ich keine Chance mehr, dem Gespräch einer Gruppe zu folgen“, erzählt El May, der in Lausanne und Boston Ingenieurwesen studiert hat. Obwohl er inzwischen auch Diskussionen in größeren Runden folgen kann, sind ihm Eins-zu-eins-Gespräche lieber. „Es ist anstrengend für mich, wenn mehrere Menschen durcheinanderreden. Da steige ich dann manchmal einfach aus.“
Ein Cochlea-Implantat für das andere Ohr möchte er nicht. „Mit dem Hörgerät in diesem Ohr höre ich zwar schlechter als mit Implantat, dafür kann ich den reichen Klang und die hohen Frequenzen beim Musikhören genießen. Das will ich nicht missen!“ Inzwischen hat El May mit Klavierunterricht angefangen. Einziges Manko: Akkorde kann er schlecht korrigieren, weil er den Unterschied zum Einzelton nicht hört. Trotz aller Abstriche – einen zumindest kleinen Vorteil hat ein Cochlea-Implantat gegenüber dem natürlichen Hören dann doch: El May kann es als Kopfhörer benutzen. Das Implantat verbindet sich via Bluetooth automatisch mit dem Smartphone. So kann er ohne Störgeräusche telefonieren, denn den „Earpod“ hat er ja schon im Ohr.
Auf den Punkt gebracht:
-
Hörstörungen im Innenohr sind durch ein Cochlea-Implantat teils zu korrigieren. Forschende entwickeln zurzeit optogenetische Implantate, die einen besseren Höreindruck erzeugen sollen als heute eingesetzte elektrische Implantate.
-
Eine neue Generation optischer Cochlea-Implantate kann mehr Frequenzen übertragen und verspricht einen besseren Höreindruck. Die erste Studie am Menschen soll 2026 starten.
Dr. Carmen Rotte
Leiterin Kommunikation & Medien
Media Contact
Alle Nachrichten aus der Kategorie: Medizintechnik
Kennzeichnend für die Entwicklung medizintechnischer Geräte, Produkte und technischer Verfahren ist ein hoher Forschungsaufwand innerhalb einer Vielzahl von medizinischen Fachrichtungen aus dem Bereich der Humanmedizin.
Der innovations-report bietet Ihnen interessante Berichte und Artikel, unter anderem zu den Teilbereichen: Bildgebende Verfahren, Zell- und Gewebetechnik, Optische Techniken in der Medizin, Implantate, Orthopädische Hilfen, Geräte für Kliniken und Praxen, Dialysegeräte, Röntgen- und Strahlentherapiegeräte, Endoskopie, Ultraschall, Chirurgische Technik, und zahnärztliche Materialien.
Neueste Beiträge

Magnetischer Speicher mit energieeffizientem MRAM freigeschaltet
Forscher der Universität Osaka stellen innovative Technologie zur Senkung des Energieverbrauchs moderner Speichervorrichtungen vor. Fortschritt in der Speichertechnologie: Überwindung der Grenzen traditioneller RAM Osaka, Japan – In den letzten Jahren…

Next-Level System-Sicherheit: Intelligenterer Zugriffsschutz für Organisationen
Fortschrittliches Framework zur Verbesserung der System-Sicherheit Forschende der University of Electro-Communications haben ein bahnbrechendes Framework zur Verbesserung der System-Sicherheit durch die Analyse von Geschäftsprozessprotokollen entwickelt. Dieses Framework konzentriert sich darauf,…

Wie mikrobielles Leben die Kalkbildung im tiefen Ozean beeinflusst
Mikroorganismen sind überall und beeinflussen die Umwelt der Erde seit über 3,5 Milliarden Jahren. Forschende aus Deutschland, Österreich und Taiwan haben nun erstmals die Rolle entschlüsselt, die Mikroorganismen bei der…



