Künstliche Herzklappe nach dem Vorbild der Natur
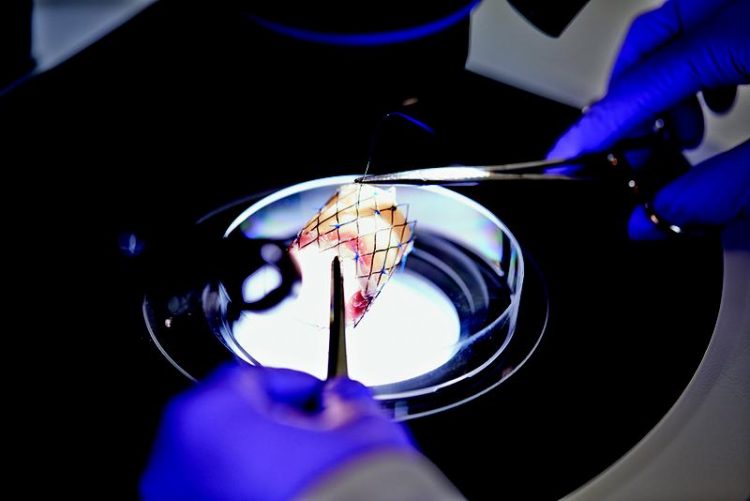
Elektrogesponnenes Trägersubstrat, eingepasst in eine Schweineherzklappe. Fraunhofer IGB
Bisherige künstliche Herzklappen wachsen im Kind nicht mit, sodass sie regelmäßig und in anspruchsvollen Operationen ausgetauscht werden müssen. Auch bei Erwachsenen halten sie lediglich etwa 25 Jahre, verkalken oder erfordern die lebenslange Einnahme antikoagulierender Medikamente.
Eine alternative künstliche Herzklappe – aus einem elektrogesponnenen Hybridmaterial – entwickelte Svenja Hinderer in ihrer Doktorarbeit am Institut für Grenzflächenverfahrenstechnik und Plasmatechnologie IGVP der Universität Stuttgart unter der Leitung von Prof. Dr. Katja Schenke-Layland, die am Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB die Abteilung Zellsysteme leitet. Für ihre Doktorarbeit »Electrospinning – a suitable method to generate scaffolds for regenerative medicine applications« wurde Dr. Svenja Hinderer am 26. November 2015 durch Bundestagspräsident Norbert Lammert mit dem von der Körber-Stiftung verliehenen Deutschen Studienpreis ausgezeichnet.
»Um ein als Klappenersatz geeignetes Material zu entwickeln, das den Zellen eine möglichst physiologische Umgebung bietet, habe ich mich in meiner Doktorarbeit immer wieder am Vorbild der Natur orientiert«, schildert Hinderer. Zunächst untersuchte die Chemikerin daher detailliert die extrazelluläre Matrix nativer Herzklappen hinsichtlich struktureller, mechanischer und biochemischer Beschaffenheit. Für die Herstellung von Trägersubstraten als Klappenmaterial entwickelte sie die Methode des Elektrospinnens weiter.
Das auf dieser Grundlage hergestellte Trägersubstrat besteht aus einem Polymergemisch, einem UV-vernetzbaren Polyethylenglykol und Polylactid (PLA). »Um die Eigenschaften des Materials weiter denen nativer Herzklappen anzugleichen, habe ich zusätzlich Proteoglykane versponnen, die unter anderem für die Wasserspeicherfähigkeit des Herzklappengewebes entscheidend sind. Wichtig war, dass die empfindlichen Proteine dabei ihre Funktion nicht verlieren«, erklärt Hinderer. Auf diese Weise gelang es ihr eine Struktur herzustellen, die morphologisch der nativen extrazellulären Matrix sehr ähnelt.
In einem Bioreaktor, der – wie das Herz Blut – Wasser durch die Klappen pumpt, simulierte Hinderer die physiologischen Drücke des Herzens, denen das Material hervorragend standhält. Videos der Bioreaktorsimulation zeigen beeindruckend, wie das Material als Herzklappenersatz die Funktion des Öffnens und Schließens übernimmt.
Ein nächster Test erfolgte in einem von einer Ingenieursstudentin in ihrem Team entwickelten Bioreaktor, in dem sie das elektrogesponnene Material zusammen mit menschlichen Zellen kultivieren konnte. »Aufgrund der speziellen mechanischen Reize im Reaktor, die denen im Körper nachempfunden waren, begannen die Zellen nach bereits sechs Tagen, elastische Fasern zu bilden. Das im Bioreaktor gereifte Gewebe wies die gleichen Strukturen auf wie eine natürliche, sich entwickelnde Herzklappe«, so Hinderer. Die elastischen Fasern verleihen Geweben, wie Haut, Blutgefäßen oder eben Herzklappen ihre Widerstandsfähigkeit und Elastizität. Sind sie einmal zerstört, kann der Mensch die Fasern nicht wiederherstellen. Sie werden nur während der Embryonalentwicklung und in den ersten Jahren nach der Geburt gebildet.
Das stabile und zugleich elastische Trägersubstrat ist biokompatibel und sterilisierbar – und damit für medizinische Anwendungen hervorragend geeignet. Zukünftiges Ziel ist es, ein zellfreies Medizinprodukt zu entwickeln, das sich erst nach dem Einsetzen in den Patienten selbst besiedelt. Dazu erforscht Hinderer, die seit Juli 2015 die Gruppe »Biomaterialien, Bioreaktoren und Bioimaging« am Fraunhofer IGB leitet, wie die Trägersubstrate mit weiteren spezifischen Proteinen modifiziert werden können, um gezielt Stammzellen anzulocken. Während die Zellen das Material besiedeln und eine neue Herzklappe mit ihrer eigenen Matrix bilden, soll das polymere Grundgerüst später im Körper abgebaut werden. Dadurch hat es das Potenzial, im Kinderherzen mitzuwachsen. Doch bis es soweit ist, muss sich die künstliche Herzklappe zunächst im Tiermodell an Schweinen beweisen.
Svenja Hinderer
Svenja Hinderer studierte von 2005 bis 2010 Angewandte Chemie an der Hochschule Reutlingen. Im Anschluss promovierte sie am Institut für Grenzflächenverfahrenstechnik und Plasmatechnologie IGVP der Universität Stuttgart, in Kooperation mit dem Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB. Im Juli 2014 schloss sie ihre Promotion in der Fakultät 4 Energie-, Verfahrens- und Biotechnik der Universität Stuttgart mit Auszeichnung ab. Seit 2014 ist Dr. Svenja Hinderer am Fraunhofer IGB als wissenschaftliche Mitarbeiterin tätig, seit Juli 2015 leitet sie hier die Gruppe »Biomaterialien, Bioreaktoren und Bioimaging«. Zudem lehrt sie an der Universitätsfrauenklinik Tübingen im Studiengang Medizintechnik.
Der Deutsche Studienpreis
Aus über 418 Bewerbungen nominierte die Jury des Deutschen Studienpreises dieses Jahr 27 junge Wissenschaftlerinnen und Wissenschaftler in den drei Sektionen »Geisteswissenschaften«, »Sozialwissenschaften« sowie »Natur- und Technikwissenschaften«. Dr. Svenja Hinderer schaffte es im Bereich »Natur- und Technikwissenschaften« auf den begehrten, mit 25 000 Euro dotierten Spitzenplatz. Kriterium für die Auswahl der Preisträger waren neben der fachwissenschaftlichen Exzellenz vor allem die spezifische gesellschaftliche Bedeutung der Forschungsbeiträge. Gefragt war dabei weniger die ökonomische Verwertbarkeit, sondern eher der gesamtgesellschaftliche Nutzen wissenschaftlicher Erkenntnis.
http://www.igb.fraunhofer.de/de/presse-medien/presseinformationen/2015/kuenstlic…
http://www.koerber-stiftung.de/wissenschaft/deutscher-studienpreis/preistraeger/…
Media Contact
Alle Nachrichten aus der Kategorie: Förderungen Preise
Neueste Beiträge

Sensoren für „Ladezustand“ biologischer Zellen
Ein Team um den Pflanzenbiotechnologen Prof. Dr. Markus Schwarzländer von der Universität Münster und den Biochemiker Prof. Dr. Bruce Morgan von der Universität des Saarlandes hat Biosensoren entwickelt, mit denen…

Organoide, Innovation und Hoffnung
Transformation der Therapie von Bauchspeicheldrüsenkrebs. Bauchspeicheldrüsenkrebs (Pankreaskarzinom) bleibt eine der schwierigsten Krebsarten, die es zu behandeln gilt, was weltweite Bemühungen zur Erforschung neuer therapeutischer Ansätze anspornt. Eine solche bahnbrechende Initiative…

Leuchtende Zellkerne geben Schlüsselgene preis
Bonner Forscher zeigen, wie Gene, die für Krankheiten relevant sind, leichter identifiziert werden können. Die Identifizierung von Genen, die an der Entstehung von Krankheiten beteiligt sind, ist eine der großen…



